Questões de Concurso
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 2.135 questões
1 - pH = - log [ H+ ] 2 - pH = pOH = 7
3 - pOH = - log [OH- ]
4 - pH menor 7 e pOH maior 7
5 - pH maior 7 e pOH menor 7
( ) Soluções básicas. ( ) Soluções ácidas.
( ) Potencial hidroxiliônico da solução.
( ) Potencial hidrogeniônico da solução.
( ) Água pura (ou soluções neutras).
( ) O indicador alaranjado de metila no meio ácido a cor fica laranja e no meio básico a cor fica amarela com seu pH variando de 3,1 a 4,4.
( ) O indicador azul de bromotimol no meio ácido a cor fica amarela e no meio básico a cor fica azul com seu pH variando de 6,0 a 7,6.
( ) O indicador vermelho de metila no meio ácido a cor fica incolor e no meio básico a cor fica rosa com seu pH variando de 8,3 a 10,0.
( ) O funil de Büchner com diversos orifícios serve para dissolver substâncias e aquecer produtos.
( ) O balão de fundo redondo é utilizado para acolar a bomba a vácuo quando necessário.
( ) O balão volumétrico é utilizado para preparar soluções e medir com precisão um volume fixo.
Fonte: https://www2.ufjf.br/quimicaead/wp - content/uploads/sites/224/2013/09/QI_Aula4
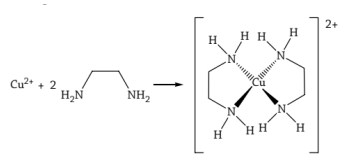
1 - Teoria Werner. 2 - Bastante útil. 3 - Teoria das cadeias.
_____________________que por ser incorreta não é mais utilizada. _____________________que mesmo não embasada, ainda pode ser usada para a explicação de alguns aspectos dos compostos de coordenação. Regra do número Atômico Efetivo, ___________________em estudos sobre carbonilas.
O indicador recomendado para determinar o ponto final dessa titulação é o(a)
Dados: Massas molares(g.mol-1 ): Na = 23,00; S = 32,07; O = 16,00
A concentração dessa solução padrão, expressa em mg SO42- L-1 , é igual a
Para atender à Portaria 2914, de 12 de dezembro de 2011, do Ministério da Saúde (2914/2011 MS) optou-se pelo método turbidimétrico para a determinação de sulfato. Este método geralmente oferece limite de quantificação (LQ) de 5mg SO42- L-1 .
A esse respeito, avalie se as afirmativas a seguir são verdadeiras (V) ou falsas (F).
( ) O método turbidimétrico baseia-se no tratamento da amostra com cloreto de magnésio e formação do precipitado MgSO4. ( ) O método turbidimétrico pode ser usado para determinação de sulfato para atendimento à portaria 2914/2011 MS, pois o LQ é menor que o valor máximo permitido para SO4 2- pela norma. ( ) No método turbidimétrico, cor e sólidos suspensos são interferentes. Nessa situação, a correção da absorvância por comparação com ensaios de brancos (nos quais não se adiciona o precipitante) é necessária.
As afirmativas são, respectivamente,
A amostra é tratada com molibdato de amônio e, posteriormente, com cloreto estanoso (método do cloreto estanoso) para a formação de um produto de coloração azul intensa. No método do ácido ascórbico, a amostra é tratada com molibdato de amônio e tartarato de potássio e antimônio e, posteriormente, com ácido ascórbico.
Nesses procedimentos, cloreto estanoso e ácido ascórbico são usados como
O reagente recomendado para esse tratamento preliminar da amostra é o
Considere a curva analítica.
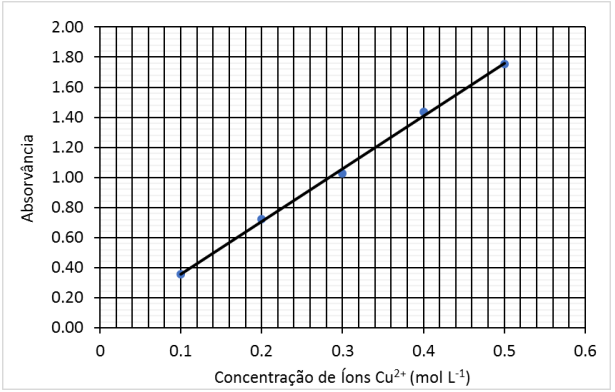
Dados: massa molar do cobre = 63,55 g.mol-1.
O teor de cobre, em % m/m, na amostra é
A equação química nesta titulação é:
B4O72- + 2 H+ + 2 H2O ➔ 4 H3BO3
Na rotina de padronização de uma solução de ácido clorídrico, 381,4 mg de bórax foram quantitativamente transferidos para Erlenmeyer, sendo dissolvidos completamente em 100mL de água. Três gotas de alaranjado de metil foram adicionados e procedeuse à titulação contra solução de HCℓ(na bureta). Na titulação, 20,0mL de solução de HCℓ foram consumidos.
A concentração da solução de HCℓ, em mol.L–1 , é, aproximadamente, igual a