Questões de Concurso
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 2.297 questões
S(s) + O2(g) → SO2(g)
A reação do enxofre foi completa, e a massa da matéria prima era 80,0 kg.
A partir dessa informação, a percentagem, em massa, de enxofre elementar na matéria prima é, aproximadamente,
Dado R = 0,082 atm L mol-1 K-1
Coluna 1 1. Densidade. 2. Concentração comum. 3. Normalidade.
Coluna 2
( ) Corresponde à relação entre a massa do soluto e o volume da solução. Pode ser expressa em g/L.
( ) É uma importante propriedade física da matéria, correspondendo à relação entre a massa da solução e o volume da solução. Pode ser expressa em g/cm³.
( ) É a relação entre o equivalente-grama do soluto (eg) e o volume da solução (em litros, por exemplo).
A ordem correta de preenchimento dos parênteses, de cima para baixo, é:
I. Mistura de acetona e água.
II. Cloreto de sódio dissolvido em água.
III. Carbonato de bário sólido em água.
[Ni(NH3)6]SO4; [CoCl2(NH3)4]Cl; K4[Fe(CN)6]; [Mn(CN)6]4-; [Fe(Cl)4]2-; [Co(Cl)3(NH3)3]
(i) um ácido forte for adicionado?
(ii) uma base forte for adicionada?
( ) Em contato com ácidos, as bases reagem por reação de neutralização, formando sal e água como produtos.
( ) As bases sofrem ionização em água, liberando íons hidroxila (OH – ).
( ) Na ionização em água, as bases aumentam a concentração de íons (OH – ).
( ) As soluções básicas são caracterizadas por valor de pH acima de 7.
A sequência correta, de cima para baixo é:
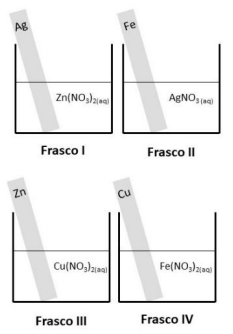
Observe, ainda, a tabela de potenciais padrão de redução (E0).

Durante essa aula experimental os alunos deverão observar evidência de fenômeno químico nos frascos:
Observe a tabela a seguir.
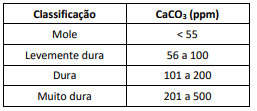
A análise de 120,0g de uma amostra de água de um manancial indicou a presença de 15,0mg de CaCO3. Essa amostra deve classificada como
• Porcentagem em massa: 70 % m/m
• Massa molar: 63 g/mol
• Densidade: 1,4 g/mL
Qual o valor da concentração da solução de ácido nítrico, em mol/L, preparada pelo químico?
Cr2 O72– (aq) + 6 Fe2+ (aq) + 14 H+ (aq) ⇌ 6 Fe3+ (aq) + 2 Cr3+ (aq) + 7 H2O
Com base na reação global dessa titulação, qual o valor mais próximo do percentual de ferro em massa no comprimido?
4 Au(minério) + 8 NaCN(aq) + O2(g) + 2 H2O(l) → 4 Na[Au(CN)2](aq) + 4 NaOH(aq)
A espécie química solúvel [Au(CN)2]− é posteriormente imobilizada sobre carvão ativado, e o ouro é recuperado por redução eletroquímica:
[Au(CN)2]−(aq) + e− → Au(s) + 2 CN−(aq)
Dados: Massa molar (g mol−1): Au = 197, NaCN = 49.
Considerando a estequiometria das reações, qual é a massa de ouro que se espera extrair, utilizando-se 1 kg de cianeto de sódio?