Questões de Concurso
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 2.297 questões
Dado: log 9 = 0.96
Dado: Densidade da solução = 1,0 g/mL
XCO3(s) → XO(s) + CO2(g)
Considerando-se a pureza do carbonato e a sua decomposição assumidamente completa, o elemento X em questão é o
6 Fe2+ (aq) + Cr2 O7 2+ (aq) + 14 H+ → 6 Fe3+ (aq) + 2 Cr3+ (aq) + 7 H2 O(l)
Com base nessas informações, a quantidade, em mol, de Fe2+ na solução de amostra é
Dentre os ácidos formados pelo cloro, aquele que apresenta o menor grau de ionização corresponde ao
A amostra reagiu com uma solução de íons oxalato em excesso, acarretando a precipitação de MgC2 O4 , conforme apresentado na reação I. Considere que o magnésio foi o único componente da amostra a precipitar.
Em seguida, o precipitado foi filtrado, lavado e calcinado (reação II), gerando uma amostra sólida de 3,05 g.
Reação I: Mg2+ (aq) + C2 O4 2- (aq) → MgC2 O4 (s)
Reação II: MgC2 O4 (s) → MgO (s) + CO (g) + CO2 (g)
A concentração, em g L-1, de magnésio na amostra é
Dado massas molares: Mg = 24 g mol-1 , O = 16 g mol-1 , C = 12 g mol-1
Nessa análise, a absortividade do analito, em L g-1 cm-1 , é
A temperatura de ebulição dessa solução sob pressão atmosférica é
Dado
constante ebuliométrica do etanol = 1,22 ºC kg mol-1 massas molares: C = 12 g mol-1, H = 1 g mol-1, O = 16 g mol-1
A dimetilglioxima é um reagente específico na análise gravimétrica.
Esse reagente é empregado para a determinação do cátion
A concentração, em g L-1 , de hidróxido de potássio na solução comercial correspondeu a, aproximadamente,
Dado massas molares: K = 39 g mol-1, H = 1 g mol-1, O = 16 g mol-1
Admitindo-se que há completa dissociação dos solutos, a concentração de íons K+ , em mol L-1 , na solução formada é igual a
A fórmula molecular desse ácido é
A massa, em gramas, de soluto a ser empregada no preparo dessa solução corresponde a
Dado massas molares: Ca = 40 g mol-1 Br = 80 g mol-1
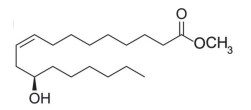
De acordo com as regras de nomenclatura da IUPAC, o nome do ricinoleato de metila é
A concentração, em mol L-1 , do hidróxido na solução é
Dado M(NaOH) = 40 g mol-1
A concentração do princípio ativo, em g L-1 , dessa solução final é, aproximadamente,