Questões de Concurso
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 2.136 questões
Assinale a alternativa que contém a resposta CORRETA.
H2 O2(aq) + 2I- (aq) → I2(aq) + 2H2 O(l)
Para tal, 1,00 mL de amostra comercial de água oxigenada foi diluída para 100,00 mL com água pura. O ponto de equivalência da titulação foi alcançado com 32,00 mL de solução do titulante.
A concentração de H2 O2 , em mol L-1 , na amostra comercial é
O valor mais próximo da pressão de vapor dessa solução, em mmHg, é
Dado: Pressão de vapor do etanol puro = 44 mmHg a 25º C Pressão de vapor da água pura = 18 mmHg a 25º C M (água) = 18,00 g mol-1 M (etanol) = 46 g mol-1
O reagente que ele deve escolher é o
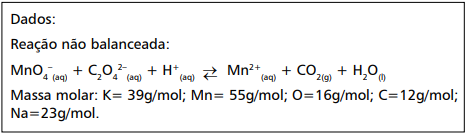
A molaridade dessa solução de KMnO4 é
HARRIS D. C. Análise Química Quantitativa. 6ª edição. Rio de Janeiro: LTC, 2005.
Durante estudo sobre erro do indicador, o analista fez uma titulação de 10,00mL de Ácido fraco (HA) 0,100mol/L (pka = 4,8) com NaOH 0,100mol/L e obteve um volume final de 9,80mL de base. O quadro abaixo apresenta três indicadores e suas faixas de viragem.
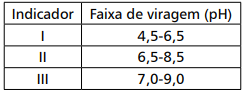
Para que o analista tenha observado esse ponto final, o(s) indicador(es) utilizado(s) foi/foram apenas
Dados: Log 49 = 1,7
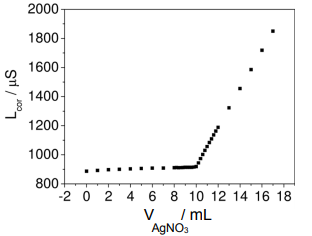
Fonte: Sartori et al (2011). Disponível em:<https://doi.org/10.1590/S0100-46702011000100008> . Acesso em: 26 fev. 2022.
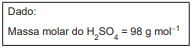
Em um laboratório, deseja-se preparar 4 L de solução aquosa de H2 SO4 com pH igual a 2 a 25ºC. Admitindo-se a ionização total de ácido, a massa de soluto, em gramas, a ser utilizada no preparo da solução é igual a
Ao se adicionar ferro metálico a uma solução aquosa de ácido nítrico, ocorre a seguinte reação química:
Fe + 4 HNO3 → Fe(NO3)3
+ 2 H2
O + NO
O sal formado nessa reação é nomeado como
A respeito de ácidos e bases, julgue o item a seguir.
Quando uma espécie ganha um próton, torna-se a base
conjugada.
A respeito de ácidos e bases, julgue o item a seguir.
Quanto mais forte for a base, mais fraco será o seu ácido
conjugado.
A respeito de ácidos e bases, julgue o item a seguir.
Por ser um ácido forte, o ácido fluorídrico é muito corrosivo.
A respeito de ácidos e bases, julgue o item a seguir.
O BF3 é uma base de Lewis porque o elemento boro (B)
pode receber um par de elétrons.