Questões de Concurso
Comentadas sobre substâncias inorgânicas: dissociação iônica e ionização, conceitos de ácido-base. em química
Foram encontradas 72 questões
A respeito de ácidos e bases, julgue o item a seguir.
O BF3 é uma base de Lewis porque o elemento boro (B)
pode receber um par de elétrons.
A respeito de ácidos e bases, julgue o item a seguir.
Um ácido de Brønsted é um receptor de próton.
reação 1: HCO2H (l) + H2O (l) ⇌ H3O+ (aq) + HCO2 – (aq) reação 2: CH3NH2 (l) + H2O (l) ⇌ CH3NH3 + (aq) + OH– (aq)
A partir dessas informações, assinale a opção que apresenta os pares conjugados ácido/base para as reações 1 e 2, respectivamente, considerando a reação direta, ou seja, o reagente ácido e sua respectiva base conjugada.
Acerca de eletroquímica e de processos de oxidação e redução, julgue o item
ma substância cujas soluções aquosas contêm íons é
chamada de eletrólito. Uma substância que não forma
íons em solução é chamada não eletrólito. Por exemplo,
as diferenças entre soluções contendo cloreto de sódio
e sacarose devem‐se, em grande parte, ao fato de o NaCl
ser iônico, enquanto o C12H22O11 é molecular.
Julgue o item, relativos a ácidos e bases.
Um exemplo simples de uma reação ácido‐base é a
reação de um próton com o íon hidróxido. Nessa reação,
o íon hidróxido é um ácido de Lewis porque recebe o par
de elétrons que se torna compartilhado com o
hidrogênio.
Julgue o item, relativos a ácidos e bases.
Pela definição de Brønsted‐Lowry, um ácido é uma
substância doadora de prótons em água e uma base é
uma substância receptora de prótons em água. Pela
definição de Lewis, um ácido é uma substância que pode
doar um par de elétrons para formar uma ligação. Uma
base de Lewis é definida como uma substância que pode
aceitar um par de elétrons para a formação de uma
ligação covalente.
Acerca das propriedades e reações características de hidretos, ácidos, hidróxidos, óxidos e sal, julgue o item
Em uma reação de neutralização, ou reação ácido‐base,
íons hidrogênio de um reagente ácido reagem com íons
hidróxido de uma base, formando água.
Considere os ácidos abaixo

Um estudante prepara soluções aquosas desses ácidos com a mesma concentração molar. Sobre esses ácidos e as
espécies presentes nas soluções, é correto afirmar que:
A tabela periódica e o modelo atômico evoluíram gradualmente ao longo do tempo, até as versões atuais. A figura precedente mostra uma ilustração bastante utilizada na representação de um átomo e que se baseia no modelo atômico de Bohr. Com relação à tabela periódica, aos modelos atômicos e aspectos a eles relacionados, julgue o próximo item.
A partir das localizações do selênio (Se) e do enxofre (S)
na tabela periódica, é possível concluir que o ácido selenídrico
(H2Se) possui acidez mais elevada do que o ácido sulfídrico
(H2S).
O modelo mais tradicional considera como ácido uma substância que libera o íon H+ e como base uma substância que libere o íon OH-. No entanto, esse modelo não contempla a neutralização de ácidos por moléculas que não contenham o íon OH-, como no caso da reação da amónia com o ácido clorídrico:
HCI(g) + NH3(I) ⇄ NH4+ + Cl-
O modelo de Lowry-Bronsted altera este modelo, de forma a abranger reações como a acima. Assinale a alternativa que corresponde a essa nova definição.
Em um laboratório de análise química, há três tambores plásticos (X, Y e Z) destinados ao descarte de soluções e nos seus rótulos se lê os seguintes dizeres:
• Tambor X: descarte de soluções ácidas.
• Tambor Y: descarte de soluções básicas.
• Tambor Z: descarte de soluções neutras.
Ao perito desse laboratório, foi solicitado que fizesse o descarte de 3 soluções aquosas (1, 2 e 3), cujas características são descritas a seguir:
• Solução 1: cloreto de sódio 0,1 mol/L.
• Solução 2: mistura de 50 mL de ácido clorídrico 0,2 mol/L, com 20 mL de hidróxido de sódio 0,5 mol/L.
• Solução 3: glicose 0,1 mol/L (lembrando que a glicose é poliálcool que apresenta ainda um grupo aldeído (C6H12O6(aq))).
Considerando que o correto descarte tenha sido feito pelo perito, assinale a alternativa correta.
As cores brilhantes observadas durante a queima de fogos de artifício são geradas a partir de elementos metálicos presentes nos fogos. Por exemplo, sais de estrôncio, como o SrCrO4, dão origem à luz vermelha; sais de cobre, como o Cu(NO3)2, à luz verde; sais de magnésio, como MgCl2, à luz branca.
Sabendo que esse fenômeno pode ser explicado com base na estrutura eletrônica dos diferentes elementos metálicos, julgue o próximo item.
Entre os elementos metálicos citados (estrôncio, magnésio
e cobre), o magnésio é o que apresenta menor energia
de ionização.
Com relação aos conhecimentos de química inorgânica e suas aplicações, julgue o próximo item.
Pode-se definir um composto de coordenação como um
composto formado entre um ácido e uma base de Lewis,
sendo o ácido de Lewis um receptor de pares eletrônicos
e a base de Lewis um doador de pares eletrônicos.
A iodometria é um método analítico indireto de titulação de iodo. Dentre os reagentes envolvidos, temos o triiodeto, que se forma segundo a reação em equilíbrio representada a seguir:
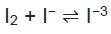
Ao analisar a equação dada e as propriedades químicas das espécies participantes, é correto afirmar
que
