Questões de Concurso
Sobre substâncias inorgânicas e suas características: ácidos, bases, sais e óxidos. reações de neutralização. em química
Foram encontradas 558 questões
Com base na situação hipotética apresentada, julgue os itens que se seguem, considerando que a solução estoque de HCl, aquosa, apresenta densidade igual a 1,19 g/mL e concentração percentual em massa igual a 37,0%.
Uma solução de HCl preparada a partir de uma solução estoque comercial deve ser padronizada por meio da titulação com uma solução padrão básica antes de ser utilizada como solução padrão ácida.
A massa de NaOH, em g, que deve ser utilizada para neutralizar todo o ácido sem que haja excesso de base é
Dados:
M(KOH) = 56 g/mol
M(NaOH) = 40 g/mol
Frasco 1: pH = 2
Frasco 2: pH = 12
Frasco 3: pH = 7
Frasco 4: pH = 4
Frasco 5: pH = 10
A partir dos valores de pH obtidos, o técnico deve ter concluído que a substância possivelmente presente no frasco
A substância resultante da reação do sódio com a água é
Metilorange foi usado como indicador do ponto final da titulação, e o volume estequiométrico da titulação foi 40 mL da solução de HCl.
A concentração da solução de hidróxido de amônio, em mol/L, é igual a
A solução utilizada pelo técnico foi
Qual a natureza das substâncias que, em geral, resultam como produto da reação química de um ácido com uma base?
Nessa rotina, ocorre a seguinte reação química da cal virgem com a água:
De posse dessa informação, o estudante fez a seguinte reflexão: “será que se algum ácido concentrado atingir minha pele, eu devo adicionar água abundante?”
Com relação à reflexão do aluno, é CORRETO afirmar que o ácido concentrado que pode gerar queimadura em sua pele quando a ele adicionar água é o
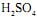 de concentração igual a 2,5 mol/L tombou e quebrou-se numa bancada de laboratório. Todo o ácido nela contido espalhou-se pela bancada. Para neutralizálo completamente pode-se utilizar, no mínimo, uma massa de cal hidratada,
de concentração igual a 2,5 mol/L tombou e quebrou-se numa bancada de laboratório. Todo o ácido nela contido espalhou-se pela bancada. Para neutralizálo completamente pode-se utilizar, no mínimo, uma massa de cal hidratada, 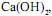 em gramas, igual a
em gramas, igual a Com o exclusivo objetivo de neutralizar o ácido, o procedimento correto deve ser o de jogar no asfalto solução aquosa de
I. Cloreto de potássio.
II. Carbonato de sódio.
III. Cloreto de amônio.
IV. Acetato de sódio.
V. Fluoreto de lítio.
quais as soluções aquosas dos sais referidos que vão apresentar um pH acima de 7?
Dados: H = 1; S = 32; O = 16; Na = 23
(Adaptado de: Revista Pesquisa FAPESP n. 198. Disponível em: http://agencia. fapesp.br/16030. Acesso em janeiro de 2013.)
O óxido citado no texto pode ser classificado como: