Questões de Concurso
Sobre substâncias inorgânicas e suas características: ácidos, bases, sais e óxidos. reações de neutralização. em química
Foram encontradas 592 questões
CrCl 3 (aq) + NaOH (aq) + H2 O 2 (aq) → NaCl (aq) + Na2 CrO 4 (aq) + H2 O (l)
Sabendo que foram gastos 50,00 mL de solução básica de CrCl 3 de concentração 0,01 mol.L-1 , a porcentagem em massa (% m) de peróxido de hidrogênio na amostra de água oxigenada é igual a:
A reação que melhor descreve esse processo é
http://www.cebrace.com.br/v2/vidro Acessado em: 08 nov. 2014
Os principais componentes do vidro são
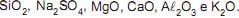
Em ordem crescente de acidez têm-se os óxidos:
Em uma indústria química, houve um derramamento acidental de H2SO4 (98 g/mol), na concentração de 8 mol/L, causando a dispersão de 200 L deste ácido em um pequeno lago. Uma equipe de técnicos foi chamada para tentar minimizar os danos para o ecossistema deste lago. Essa equipe decidiu que a adição de bicarbonato de sódio NaHCO3 (84 g/mol) seria a melhor solução imediata para tentar recuperar o lago. A massa de mínima de NaHCO3, necessária para reagir com o ácido derramado, é:
I - Sais 1 - São compostos que possuem como íons negativos exclusivamente os ânions OH-.
II - Bases 2 - São compostos iônicos que possuem pelo menos um cátion diferente de H+ e pelo menos um ânion diferente de OH-.
III - Óxidos 3 - São substâncias que se ionizam em solução aquosa, libertando ions H+.
IV - Ácidos 4 - São compostos binários formados por um elemento químico qualquer e pelo oxigênio.
A classificação e separação das espécies segundo sua função química é uma das atribuições do técnico responsável por um laboratório. Os rótulos nos reagentes importados contêm os nomes originais dos produtos. Nesse sentido, numere a coluna da direita com base na informação contida no rótulo do produto mostrada na coluna da esquerda.
1. Phosphorus pentoxide.
2. Trifluoromethanesulfonic acid, reagent grade.
3. n-Butyllithium solution.
4. Ammonium hexafluorophosphate.
( ) Sal.
( ) Ácido.
( ) Óxido.
( ) Base.
Assinale a alternativa que apresenta a numeração correta da coluna da direita, de cima para baixo.
I - Sais
II - Bases
III - Óxidos
IV - Ácidos
1 - São compostos que possuem como íons negativos exclusivamente os ânions OH-
2 - São compostos iônicos que possuem pelo menos um cátion diferente de H+ e pelo menos um ânion diferente de OH- .
3 - São substâncias que se ionizam em solução aquosa, libertando ions H+ .
4 - São compostos binários formados por um elemento químico qualquer e pelo oxigênio.