Questões de Concurso
Sobre substâncias inorgânicas e suas características: ácidos, bases, sais e óxidos. reações de neutralização. em química
Foram encontradas 592 questões
Um dos critérios que pode ser utilizado para classificar águas naturais é o de dureza, propriedade que resulta da dissolução de minerais do solo e das rochas ou do aporte de resíduos industriais.
A classificação de águas naturais, de acordo com a dureza, é expressa em função da concentração de
Os ciclos biogeoquímicos contribuem para a troca de matéria e energia entre a hidrosfera, a atmosfera e a litosfera.
O ciclo hidrológico está relacionado à distribuição da energia solar assim como as propriedades da água estão relacionadas às seguintes funções:
I. ao transporte de nutrientes no meio aquoso.
II. à alta solubilização de espécies iônicas.
III. à flutuação do gelo e à circulação vertical de nutrientes na coluna d’água.
IV. à estabilização da temperatura da biota.
A água realiza essas funções graças às seguintes propriedades:
Leia o fragmento a seguir.
"Os alquimistas do século XIV tornaram-se os primeiros a compreender a natureza dos ácidos. O único ácido conhecido pelos antigos fora o ácido acético fraco do vinagre. No século VIII, Djabir havia preparado uma solução fraca de ácido nítrico e outros alquimistas árabes descobriram que a destilação do vinagre produzia um ácido acético mais forte. Mesmo o ácido acético forte, porém, pouco tinha de corrosivo. Não parecia ser dotado de muito poder reagente.”
(STRATHERN, P. O sonho de Mendeleiev. A verdadeira história da química. 2002, Zahar, p. 57).
Com relação aos ácidos, assinale V para a afirmativa verdadeira e F para a falsa.
( ) O ácido acético pode ser classificado como forte ou fraco dependendo do valor do seu Ka, o que explica as observações obtidas pelos alquimistas.
( ) O ácido nítrico é um ácido fraco, o que corresponde ao observado experimentalmente pelos alquimistas.
( ) Tanto o ácido acético como o ácido nítrico são ácidos fortes, porém os alquimistas não tinham informações suficientes para classificá-los corretamente.
As afirmativas são, respectivamente,
Leia o fragmento a seguir.
“O objetivo da atividade é evidenciar que esse tipo de transformação envolve a formação de novas substâncias e que podem ser acompanhadas de aspectos facilmente perceptíveis ou evidências.”
(MACHADO, A.H. Aula de Química: discurso e conhecimento. Ed. UNIJUÍ, Ijuí, 3ª ed., 2014.)
Em uma das práticas apresentadas pela autora, os alunos deveriam misturar em um tubo de ensaio três gotas de solução de nitrato de chumbo II e três gotas de bicromato de potássio.
Ao realizar esse experimento, os alunos deveriam observar
O quadro abaixo representa os equilíbrios ácido-base entre o ácido sulfuroso e amônia em solução aquosa.
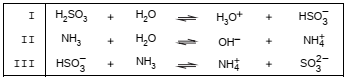
De acordo com a teoria de Brönsted-Lowry,
Uma professora propõe uma aula à beira do mar para observar transformações químicas visíveis que a maresia provoca nesse ambiente. Maresia é o nome dado a uma névoa fina, úmida e salgada que às vezes paira sobre as cidades do litoral, flutuando ao longo da costa. Esse spray é formado por bilhões de gotículas de água do mar, que sobem ao ar toda vez que uma onda arrebenta na praia. O fenômeno que essa névoa provoca é retratado pelos estudantes, ao caminhar pela praia, e apresentado abaixo.

O processo químico apresentado nessas imagens pode ser classificado como uma reação de
Ao reagir com água, o óxido nitroso apresenta o comportamento de
Em 1923, o químico dinamarquês Johannes Brønsted (1879- 1947) e o químico inglês Thomas Lowry (1874-1936) propuseram uma definição de ácidos e bases mais geral do que a proposta anteriormente por Arrhenius (1859-1927).
O conceito de Brønsted- Lowry está baseado no fato de que a reação ácido-base envolve transferência de íons H+ de uma substância para outra.
Analise o equilíbrio a seguir:
HSO3 – (aq)+ H2O(ℓ) ⇄ H2SO3(aq) +OH– (aq)
Baseado nesse conceito, os pares conjugados são:
Um frasco de ácido clorídrico concentrado contém 37% de HCl em massa e apresenta uma densidade de 1,20 g mL-1 . Foi transferido 5,00 mL de HCl desse frasco para um balão volumétrico de um litro e avolumado com água deionizada.
Qual o volume necessário dessa solução de HCl diluída para neutralizar 500 mL de NaOH 0,02 mol L-1 ?
Uma _______________________ constitui uma excelente solução para a neutralização de soluções ácidas para descarte, pois além de elevar o pH, promove a formação de bolhas atóxicas que, quando cessadas, possibilitam que o usuário perceba que o meio já se encontra em pH próximo ao neutro.
A alternativa que completa a frase de forma CORRETA é:
Analise as afirmativas abaixo sobre a classificação e propriedades dos óxidos, julgue se são VERDADEIRAS (V) ou FALSAS (F) e marque a alternativa que contém a sequência CORRETA.
( ) Os óxidos ácidos formam ácido quando reagem com água, e quando reagem com base formam sal e água.
( ) Óxidos neutros não reagem nem com água, ácido ou base. Podemos citar como exemplos de óxidos neutros o CO e o CO2.
( ) O óxido de cálcio, CaO, também chamado de cal viva, é um exemplo de óxido básico. Quando o CaO reage com a água, é formado o hidróxido de cálcio, Ca(OH)2, também chamado de cal hidratada ou cal extinta.
( ) O dióxido de enxofre é um óxido ácido e é um dos óxidos contribuintes para a chamada chuva ácida.