Questões de Concurso
Sobre técnicas de laboratório em química
Foram encontradas 2.777 questões
A medição de volumes líquidos é uma parte importante de muitos experimentos. Em alguns casos, os volumes medidos precisam de uma grande precisão, e em outros casos não. Nos laboratórios de Química, o volume pode ser medido de maneira confiável com uma pipeta, uma bureta ou um frasco volumétrico. Sobre as principais vidrarias de precisão, assinale com V as afirmativas verdadeiras e com F as falsas.
( ) As pipetas permitem a transferência de volumes exatamente conhecidos de um recipiente para outro.
( ) Uma bureta consiste em um tubo calibrado para abrigo do titulante mais uma válvula pela qual a vazão do titulante é controlada.
( ) As buretas são utilizadas para a preparação de soluções-padrão e para a diluição de amostras, a volumes fixos, antes da tomada de alíquotas com uma pipeta.
( ) Uma pipeta é utilizada nas titulações durante os processos de preparo e padronização de soluções.
Assinale a sequência CORRETA.
O preparo de soluções é uma das atividades essenciais na vida profissional do técnico de laboratório em Química. O hidróxido de sódio é a base mais utilizada no preparo de soluções-padrão, embora os hidróxidos de potássio e de bário sejam também empregados.
Considere que um técnico de laboratório em Química, durante o preparo de uma solução-padrão de hidróxido de sódio (NaOH), realizou os seguintes procedimentos:
I. Considerou o grau de pureza da base, no rótulo do reagente, para calcular a massa do NaOH necessária para o preparo da solução.
II. Colocou a quantidade já pesada da base em um béquer e dissolveu em água destilada, usando um bastão de vidro para facilitar a dissolução.
III. Transferiu, quantitativamente, com o auxílio de uma bureta, o volume total de água que interage com o hidróxido de sódio.
Estão corretos os procedimentos:
A cromatografia é um método físico-químico de separação e está fundamentada na migração diferencial dos componentes de uma mistura, que ocorre devido a diferentes interações, entre duas fases imiscíveis: a fase móvel e a fase estacionária. Entre os vários tipos de cromatografia, destacam-se a cromatografia em camada delgada (CCD), a cromatografia líquida de alta eficiência (CLAE) e a cromatografia gasosa de alta resolução (CGAR).
Sobre os tipos de cromatografia, assinale a alternativa INCORRETA.
Considere que um estudante trabalhando com duas balanças A e B registrou as seguintes massas de um mesmo material:

Com base nessas informações, o estudante fez as seguintes afirmações:
I. Não há diferença entre as massas.
II. A balança B tem maior incerteza.
III. A balança A tem mais algarismos significativos.
Sobre as proposições descritas, do ponto de vista científico, estão incorretas as afirmações:
A seguir, é feita a descrição de vidrarias comumente utilizadas em laboratório.
I. Aparelho usado em análises volumétricas. É um instrumento de medição e transferência rigorosa de volumes. II. Peça geralmente de porcelana, cuja utilidade é aquecer substâncias a seco e com grande intensidade. Pode ser levado diretamente ao bico de Bünsen.
III. Usado para armazenar substância em atmosfera com baixo índice de umidade. É um recipiente fechado que contém um agente secante.
IV. Utilizado em titulações, aquecimento de líquidos e para dissolver substâncias e proceder reações entre soluções.
V. Serve para medir e transferir volumes de líquidos. Não pode ser aquecido.
A sequência que corretamente identifica as vidrarias descritas é
As atividades realizadas nos laboratórios didáticos de Química precisam ser acompanhadas do descarte correto dos resíduos produzidos durante as aulas experimentais, sendo importante classificar os resíduos e escolher o tratamento mais adequado. Nesse sentido, numere a coluna da direita de acordo com sua correspondência com a coluna da esquerda.
1. Resíduos básicos concentrados, p. ex. aminas. / ( ) Tratar com sulfito de sódio e depois ajustar o pH entre 7 e 9.
2. Resíduos fortemente oxidantes em solução, p. ex. permanganato. / ( ) Recobrir o resíduo com enxofre em pó e armazenar.
3. Resíduo de mercúrio metálico. / ( ) Diluir até obtenção de uma solução com pelo menos 50% de água (em volume) e, em seguida, ajustar o pH entre 7 e 9.
4. Resíduo contendo sais de cianeto em solução aquosa diluída. / ( ) Adicionar 1 grama de NaOH por 100 mL de solução. Adicionar água sanitária.
Assinale a alternativa que apresenta a numeração correta da coluna da direita, de cima para baixo.
A tabela a seguir resume a proporção m/z e suas respectivas abundâncias relativas (%) para os picos de um espectro de massa de um composto puro.
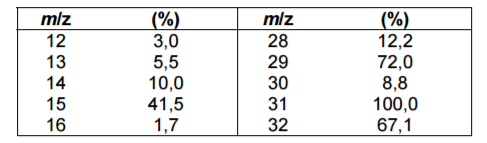
Da tabela, o pico base e o pico devido ao íon molecular do composto são, respectivamente, os de proporção
m/z igual a