Questões de Concurso
Sobre teoria atômica: átomos e sua estrutura - número atômico, número de massa, isótopos, massa atômica em química
Foram encontradas 379 questões
Com relação a esse assunto, julgue os itens.
I - Um balão cheio com 1 L de gás carbônico
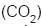 não flutua, mas murcha, porque o
não flutua, mas murcha, porque o 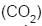 é mais denso do que o ar.
é mais denso do que o ar. II - Um balão cheio com hélio flutua porque este gás, apesar de ser mais denso do que o ar, possui menor volume molar, devido ao seu menor raio atômico.
III - Dois balões contendo 1 L de gás carbônico ou de hélio terão massas iguais destes gases, já que um mol de qualquer gás, nas condições ideais, ocupa 22,4 L.
(Dados: massa molar do
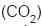 = 44 g/mol
= 44 g/mol massa molar do He = 4 g/mol
massa molar média do ar = 29 g/mol)
É(São) correta(s) APENAS a(s) afirmativa(s)
Átomo é a menor partícula em que um elemento pode ser dividido e que ainda apresente as propriedades do elemento em questão.
( ) Foi construída empiricamente muito antes de serem conhecidas as estruturas dos átomos a partir das propriedades físicas e químicas dos elementos.
( ) Os períodos da tabela periódica são numerados de acordo com o número quântico principal da camada de valência.
( ) O raio atômico de um elemento é definido como a distância entre os núcleos de átomos vizinhos.
( ) A energia de ionização é a energia mínima necessária para remover um elétron de um átomo no estado gasoso e no seu estado fundamental.
( ) A afinidade eletrônica de um elemento é a energia liberada por um átomo ao receber um elétron.
A ordem correta de preenchimento dos parênteses, de cima para baixo, é:
Professor Adriano, D. A; Ciências Físicas e Biomoleculares, USP-IFSC, Modulo_19.pdf.
Marque a alternativa que contém um par de Isosteros.
Considere: C (Z=6); N (Z=7); H (Z=1); O (Z=8); P (Z=15); R= substituinte qualquer.
O nitroprussiato de sódio — Na2[Fe(CN)5NO] — é um composto empregado como fonte de óxido nítrico — um potente vasodilatador — administrado por via intravenosa em pacientes em situação de emergência hipertensiva. O uso inadequado desse medicamento, que é sensível à luz e que produz cianeto em sua decomposição, pode causar morte acidental por déficit de oxigênio no organismo.
Com base nas informações apresentadas, julgue o próximo item.
Caso todos os ligantes desse composto fossem substituídos por
íons Br–
, o ânion gerado seria o hexabromoferrato(III), que
absorve radiação em comprimento de onda maior que o
absorvido pelo Na2[Fe(CN)5NO].
Uma transição eletrônica envolve a transferência de um elétron de um orbital para outro. Tanto os átomos (orbitais atômicos) como as moléculas (orbitais moleculares) podem sofrer esse tipo de transição. A diferença de energia entre os orbitais 3s e 3p para o átomo de sódio é de 2,107 eV. Indique qual o comprimento de onda da radiação que será absorvida ao se excitar um elétron de um orbital 3s para o orbital 3p.
Dados:
Constante de Planck (h)=6,63 x 10-34 J s
1eV = 1,60 x 10-19 J)
Sobre a classificação periódica dos elementos, a estrutura da classificação periódica, suas relações com a configuração eletrônica e as principais propriedades periódicas. Julgue as sentenças a seguir:
I. O elemento Boro (B, Z = 5, massa atômica = 11) é classificado como um metal alcalino.
II. Os elementos inseridos no grupo dos lantanídeos apresentam o elétron de diferenciação em um orbital .
III. O Iodo (I, Z = 53) apresenta raio atômico menor que o Cloro (Cl, Z =17).
IV. Os elementos Cálcio (Ca), Magnésio (Mg) e Rádio (Ra) são classificados como metais alcalinos terrosos.
V. A eletronegatividade diminui à medida que se aumenta o período da tabela periódica
O complexo [M(NH3)6] +3 contém um total de 126 elétrons.
Indique a opção que aponta o número atômico de M e a geometria espacial do composto de coordenação em questão.
O nitroprussiato de sódio — Na2[Fe(CN)5NO] — é um composto empregado como fonte de óxido nítrico — um potente vasodilatador — administrado por via intravenosa em pacientes em situação de emergência hipertensiva. O uso inadequado desse medicamento, que é sensível à luz e que produz cianeto em sua decomposição, pode causar morte acidental por déficit de oxigênio no organismo.
Com base nas informações apresentadas, julgue o próximo item.
Caso todos os ligantes desse composto fossem substituídos por
íons Br–
, o ânion gerado seria o hexabromoferrato(III), que
absorve radiação em comprimento de onda maior que o
absorvido pelo Na2[Fe(CN)5NO].
13Al2+ 11Na 10Ne+
Pode-se dizer que elas são: