Questões de Concurso
Sobre teoria atômica: átomos e sua estrutura - número atômico, número de massa, isótopos, massa atômica em química
Foram encontradas 372 questões
Na figura abaixo, podemos observar o ponto de ebulição dos elementos da família 16 da tabela periódica, ligados ao hidrogênio. Um comportamento excepcional da água é notado, comparando-se seu ponto de ebulição com o das substâncias moleculares do restante do grupo.
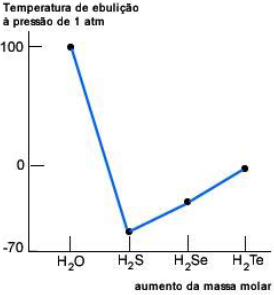
De acordo com a análise do gráfico acima, é CORRETO afirmar:
A variação das abundâncias dos isótopos estáveis é ocasionada por processos físicos de mudança de fase, como evaporação e condensação.
I – NaCl II – KBr III – MgCl 2 IV – AlCl 3 V – LiF
I- metal alcalino-terroso
II- em sais pode ter número de oxidação-1
III- em sais pode ter número de oxidação+7
IV- sua configuração eletrônica termina com s1
Os seguintes elementos correspondem respectivamente às informações I a IV: