Questões de Concurso
Sobre teoria atômica: átomos e sua estrutura - número atômico, número de massa, isótopos, massa atômica em química
Foram encontradas 372 questões
Com relação aos significados de mistura, molécula e substância, julgue o item a seguir.
Molécula é a menor porção de um composto, com um
grupo variável de átomos ligados em um arranjo mutável
e eletricamente neutro.
I - A molécula de BF₃ contém um átomo com octeto incompleto. II - As moléculas PCl₅ e SiF₄ apresentam átomos de fósforo e enxofre com 12 elétrons e 10 elétrons na camada de valência, respectivamente. III - Algumas moléculas podem apresentar elétrons desemparelhados, tais como NO e ClO₂
Está correto o que se afirma em

1 - Metais Alcalinos ( ) ns² np⁵ 2 - Metais Alcalinos Terrosos ( ) ns¹ 3 - Calcogênios ( ) ns² 4 - Halogênios ( ) ns² np⁴
Marque a sequência correta.
As cores brilhantes observadas durante a queima de fogos de artifício são geradas a partir de elementos metálicos presentes nos fogos. Por exemplo, sais de estrôncio, como o SrCrO4, dão origem à luz vermelha; sais de cobre, como o Cu(NO3)2, à luz verde; sais de magnésio, como MgCl2, à luz branca.
Sabendo que esse fenômeno pode ser explicado com base na estrutura eletrônica dos diferentes elementos metálicos, julgue o próximo item.
No estado fundamental de energia, o íon Cu2+ apresenta
6 elétrons em orbitais s, 12 elétrons em orbitais p e 9 elétrons
em orbitais d.
As cores brilhantes observadas durante a queima de fogos de artifício são geradas a partir de elementos metálicos presentes nos fogos. Por exemplo, sais de estrôncio, como o SrCrO4, dão origem à luz vermelha; sais de cobre, como o Cu(NO3)2, à luz verde; sais de magnésio, como MgCl2, à luz branca.
Sabendo que esse fenômeno pode ser explicado com base na estrutura eletrônica dos diferentes elementos metálicos, julgue o próximo item.
O isótopo neutro Ba-88 possui 38 prótons e 50 nêutrons em
seu núcleo, além de 38 elétrons na região extranuclear.
Com relação aos conhecimentos de química inorgânica e suas aplicações, julgue o próximo item.
Na tabela periódica, os elementos estão apresentados
em ordem decrescente de volume atômico (volume
molar). Essa organização resulta em famílias de
elementos com propriedades químicas díspares
distribuídos em camadas na tabela periódica.
A Teoria do Orbital Molecular (TOM) permite prever a existência de espécies, como íons moleculares,sua estabilidade relativa e algumas propriedades. Entretanto a TOM não prevê a existência da espécie He2. Porém essa espécie existe apenas à temperatura de 4,5 K, possuindo comprimento de ligação de 52 angstrons e energia de ligação de 9,63x10-3J mol-1 determinados experimentalmente. Com base na TOM,avalie as afirmações a seguir.
Dado He (Z = 2)
I. A espécie He2 possui ordem de ligação igual a zero e é estável.
II. Ordem de ligação no íon molecular He2+é menor que no dímero de hélio
III. O comprimento de ligação do He2+é menor que do He2.
IV. As energias dos orbitais moleculares 1σg e 1σu do He2+e H2+ são as mesmas.
Assinale a alternativa que apresenta somente as afirmações CORRETAS:
Abaixo estão várias configurações eletrônicas que podem estar corretas para o átomo de nitrogênio (Z = 7). Os elétrons são representados por setas cuja direção indica o valor do número quântico spin, ms. Os três círculos para os orbitais p indicam os possíveis valores para o número quântico magnético, ml. Os estados podem ser classificados como fundamental se a configuração eletrônica representa o estado fundamental do átomo de nitrogênio, excitado se a configuração representa um possível estado excitado, ou proibido, se a configuração não pode existir.
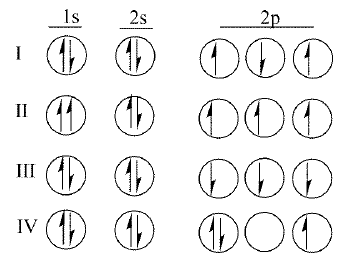
A classificação dos estados representados nas configurações de I a IV, nesta ordem, é:
Leia o fragmento a seguir.
Seleção aponta tomateiro tolerante a metal pesado
No programa de Pós-Graduação em Genética e Melhoramento de Plantas da Escola Superior de Agricultura Luiz de Queiroz (Esalq) da USP, em Piracicaba, pesquisa seleciona cultivares de tomateiro tolerantes ao metal pesado cádmio. O objetivo do estudo do engenheiro agrônomo Fernando Angelo Piotto é entender as alterações genéticas, fisiológicas e bioquímicas destas plantas provocadas pela exposição ao metal, que ajudarão a desenvolver meios de controle da contaminação.
(Agenda USP de Notícias. Disponível em: http://www.usp.br/agen/?p=105407)
Quanto à estrutura do átomo do elemento citado no texto, esse apresenta semelhanças com
Dado: Número Atômico: Cd = 48
A medicina nuclear envolve dois usos distintos de radioisótopos: terapia e diagnóstico. No uso terapêutico, a radiação é empregada na tentativa de curar doenças. Algumas formas de câncer, por exemplo, podem ser tratadas por radioterapia (...) Os radioisótopos também podem ser empregados com o propósito de diagnóstico, fornecendo informações sobre o tipo ou extensão da doença. O isótopo iodo-131 é usado para determinar o tamanho, forma e atividade da glândula tireóide. (Fonte: Química Nuclear na Medicina. http://www.qmc.ufsc.br)
A representação do iodo-131 faz referência
Leia o fragmento a seguir.
Bomba de sódio-potássio: membrana citoplasmática regula a passagem de íons
Existem substâncias que devem estar presentes, em diferentes concentrações, dentro e fora das células. Por exemplo, as células humanas mantêm uma concentração interna de íons potássio (K+) cerca de 20 a 40 vezes maior que a concentração existente no meio extracelular. Por outro lado, a concentração de íons sódio (Na+) se mantém, no interior das nossas células, cerca de 8 a 12 vezes menor que a do exterior.
(Fonte: http://educacao.uol.com.br/disciplinas/biologia/htm)
Em relação aos elementos citados no texto, assinale a afirmativa correta.
Dados: número atômico do Na = 11. / número atômico do K = 19
A pólvora negra, ainda utilizada em muitos cartuchos, tem a seguinte composição aproximada : 75% salitre, 13% carvão vegetal e 12% enxofre(...) quando do disparo de arma de fogo, essa mistura termina por gerar dentre os resíduos sólidos: sulfatos (…).
(Fonte: FARIAS,R.F. Introdução à Química Forense .3ª edição. Campina, SP: Editora Átomo, 2010.)
Uma amosta de 100 gramas de pólvora negra poderá gerar uma massa, em gramas, de sulfato de sódio de, no máximo,
Dados:
massa molecular de Na2SO4 = 142u
massa atômica do S = 32 u
Sobre tais elementos, assinale a afirmativa correta.
Sobre as ligações químicas, analise as afirmativas.
I. A característica principal das ligações iônicas é a grande diferença de eletronegatividade entre os átomos. Um átomo deve ter baixa energia de ionização e o outro uma elevada afinidade eletrônica.
II. A atração eletrostática entre os íons na ligação iônica é a força mais significativa da estabilização da ligação.
III. A baixa energia de ionização necessária para uma ligação iônica é característica dos metais. A alta energia de afinidade eletrônica, que também é necessária para uma ligação iônica, é uma característica dos elementos químicos não metálicos, que necessitam de um, dois ou três elétrons para completar suas camadas de valência.
Está(ão) correta(s) a(s) afirmativa(s)
Sobre as ligações químicas, analise as afirmativas.
I. Nas estruturas de Lewis, a ligação covalente resulta do compartilhamento de um par de elétrons entre dois átomos. Esse compartilhamento é uma característica particular das ligações encontradas na maioria das moléculas orgânicas.
II. Com o desenvolvimento da mecânica quântica, Linus Pauling introduziu o conceito de ressonância para explicar o tipo de situação, em que duas possíveis estruturas de Lewis coexistiriam sob a forma de estruturas ressonantes. Por exemplo, a representação das ligações no O3 é uma média de duas estruturas ressoantes possíveis.
III. Quando ocorre a ligação química pela transferência de elétrons de um átomo (que fica positivo) para outro átomo (que fica negativo), a ligação formada denomina‐se ligação iônica.
Está(ão) correta(s) a(s) afirmativas
Para cada átomo a seguir foi atribuído um número.
(0)Li (3)Be (6)F (10)Cl (20)Na
A soma dos números que correspondem ao
átomo com o maior raio e ao átomo com a maior
primeira energia de ionização é: