Questões de Concurso
Sobre teoria atômica: átomos e sua estrutura - número atômico, número de massa, isótopos, massa atômica em química
Foram encontradas 374 questões
Nanopartículas esféricas de ouro são estruturas que contêm centenas de átomos de Au. A superfície dessas nanopartículas apresenta carga elétrica advinda de uma camada de íons provenientes do reagente usado na redução do Au3+ para o Au que forma a nanopartícula. A elevada relação superfície-volume e a carga superficial mantêm as nanopartículas dispersas homogeneamente no meio aquoso.
Considerando que cada uma das nanopartículas tenha 100 átomos de Au e que a concentração de Au3+ na reação que originou a dispersão era de 1 x 10-6 mol L-1, o número de nanopartículas de ouro em 5 mL de dispersão aquosa será de
Dado
1 mol de átomos = 6 x 1023 átomos
Os elementos 26Fe e 28Ni no estado oxidado podem formar compostos de coordenação. Quais são os orbitais hibridizados para cada complexo metálico abaixo:
Complexo 1= [Fe(CN)6]K3,
Complexo 2= [Ni(CN)5]K3,
Complexo 3=[Ni(NH3)6]Cl2
A tabela periódica é dividida em grupos e períodos. As propriedades periódicas dos elementos são determinadas pela estrutura eletrônica do átomo. Sobre o assunto, considere as seguintes afirmativas:
1. O raio atômico num grupo de um metal de transição praticamente não varia entre átomos do quinto e sexto períodos.
2. A primeira energia de ionização de um átomo é maior que sua segunda energia de ionização.
3. A afinidade eletrônica do F (Z = 9) é maior que do Ne (Z = 10).
4. A eletronegatividade de um átomo do grupo II é menor que a de um átomo do grupo XV.
Assinale a alternativa correta.
A utilização de um determinado elemento químico requer o conhecimento de suas propriedades. Para materiais condutores, por exemplo, são utilizados elementos metálicos, os quais podem ser moldados na forma de fios. As propriedades dos elementos, entre elas a condutividade, estão ligadas à sua configuração eletrônica de valência, que, por sua vez, pode ser obtida a partir dos valores sucessivos de energia de ionização (E.I). A partir da configuração eletrônica de valência, pode-se determinar a qual grupo da tabela periódica um elemento representativo pertence. Uma grande variação relativa do valor da E.I indica que o elétron é retirado de uma camada mais interna e os anteriores, consequentemente, da camada de valência. Observe os Quadros 1 e 2.
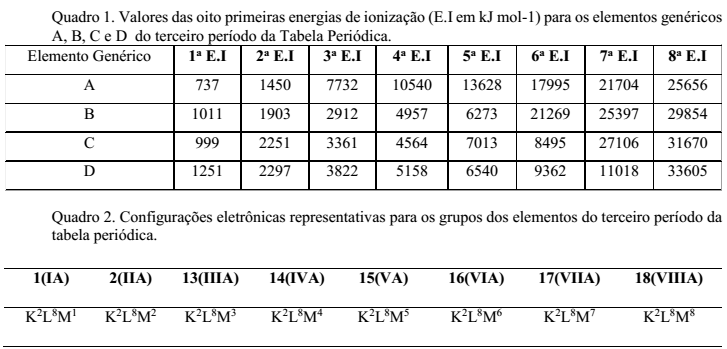
O elemento genérico adequado para obtenção de um fio condutor é:
A massa atômica relativa dos elementos é obtida pela determinação da média ponderada de seus isótopos. Dentre os elementos do grupo 14 da tabela periódica, mostrados abaixo, o que apresenta maior incerteza na sua massa atômica relativa é o
Elemento: C; Si; Ge; Sn; Pb
Massa Atômica relativa (u): 12,011; 28,086; 72,61(2); 118,71; 207,2
O Diagrama de Orbitais Moleculares (DOM) para o íon molecular H2 + pode ser obtido pela Combinação Linear de Orbitais Atômicos (CLOA) das funções de onda normalizadas que designam o orbital s de um átomo de hidrogênio a, representado como 1sa, com a função onda normalizada do átomo de hidrogênio b, representado como 1sb. Essas combinações lineares estão mostradas abaixo:

A ordem de ligação em H2 + é
Dado: 1H = 1s1.
Em um experimento, para determinar a massa atômica de um elemento, foi constatado que a massa determinada era 140 vezes mais pesada do que um átomo de hidrogênio. Sabendo que o número de prótons é igual a 59, determine o número de átomos em um 1 kg de amostra desse elemento:
