Questões de Concurso
Sobre teoria atômica: átomos e sua estrutura - número atômico, número de massa, isótopos, massa atômica em química
Foram encontradas 372 questões
I. O elemento Césio (Cs) é mais eletropositivo que o elemento Bário (Ba).
II. O elemento Césio (Cs) tem maior raio atômico que o elemento Potássio (K).
III. O elemento Flúor (F) é mais eletronegativo que o elemento Iodo (I).
IV. O íon Ba⁺² possui raio atômico maior comparado ao do íon Ba⁺¹.
Quais estão corretas?
Dados Massa Atômicas em g/mol: Fe= 56 O= 16 H= 1
Texto 19A1AAA
O titânio, um metal de transição do “bloco d” da tabela periódica, é bastante empregado em ligas metálicas devido a sua elevada resistência mecânica e baixa tendência à corrosão, além da baixa densidade. Ele é obtido a partir, principalmente, da ilmenita (FeTiO3) e do rutilo (TiO2).
Assinale a alternativa correta:
As figuras a seguir apresentam micrografias dos três tipos citados de alotropia do Fe e diferentes esquemas de estrutura atômica.
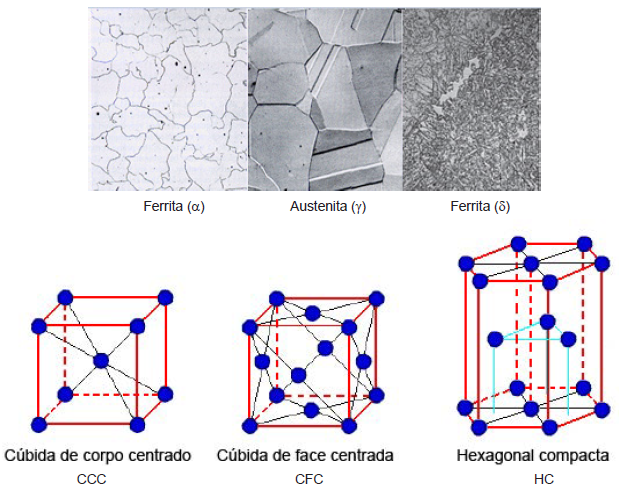
Assinale a alternativa que apresenta a correta associação entre a fase do ferro e sua estrutura atômica.
As letras W, X, Y e Z representam átomos de quatro elementos e suas distribuições eletrônicas.
As letras não correspondem aos símbolos dos elementos.
Relacione os elementos às suas respectivas características.
W – 2 : 4
X – 2 : 8 : 1
Y – 2
Z – 2 : 8 : 14 : 2
( ) Gás inerte menos denso que o ar.
( ) Reage com a água, produzindo uma base e gás hidrogênio, liberando grande quantidade de calor.
( ) Metal do quarto período da tabela periódica.
( ) Ametal típico das moléculas orgânicas.
Assinale a opção que mostra a relação correta, segundo a ordem apresentada.
Qual é o volume ocupado por 270 g de alumínio, em cm3, e qual é o número aproximado de átomos contido nesse volume, respectivamente?
Dado Uma unidade atômica de massa corresponde a 1,66 x 10-27kg. A densidade do alumínio vale 2,7 g/cm3

