Questões de Concurso
Sobre teoria atômica: átomos e sua estrutura - número atômico, número de massa, isótopos, massa atômica em química
Foram encontradas 379 questões
1. eletronegatividade; 2. energia de ionização; 3. afinidade eletrônica; 4. eletropositividade.
( ) Energia liberada quando um elétron adicional é acrescentado a um átomo no estado gasoso.
( ) Energia mínima necessária para remover um elétron de um átomo ou íon no estado gasoso.
( ) Tendência do átomo em doar elétrons durante as ligações químicas.
( ) Tendência que um átomo tem de atrair elétrons para si em uma ligação química em uma molécula isolada.
A sequência correta, de cima para baixo, é:
I. Na tabela periódica, o volume atômico dos elementos não varia periodicamente, ou seja, não varia em intervalos regulares.
II. A massa atômica dos elementos químicos varia periodicamente com o aumento ou diminuição do número atômico.
Considerando as proposições acima apresentadas, é correto afirmar que
Assinale a alternativa correta em relação ao assunto.
Com base nessas informações, assinale a alternativa que indica, respectivamente, o número atômico (Z) e o número de massa (A) desse átomo.
Assinale a alternativa que indica corretamente a composição nuclear que o átomo do elemento químico fósforo apresenta.
Fonte: Reações Químicas. Disponível em:<http://www.foz.unioeste.br/~lamat/downquimica/capitulo5.pdf>.
Marque a alternativa que descreve CORRETAMENTE sobre essas reações.
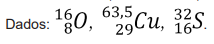
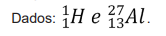
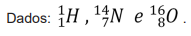
( ) Foi construída empiricamente muito antes de serem conhecidas as estruturas dos átomos a partir das propriedades físicas e químicas dos elementos.
( ) Os períodos da tabela periódica são numerados de acordo com o número quântico principal da camada de valência.
( ) O raio atômico de um elemento é definido como a distância entre os núcleos de átomos vizinhos.
( ) A energia de ionização é a energia mínima necessária para remover um elétron de um átomo no estado gasoso e no seu estado fundamental.
( ) A afinidade eletrônica de um elemento é a energia liberada por um átomo ao receber um elétron.
A ordem correta de preenchimento dos parênteses, de cima para baixo, é:
Considerando a configuração eletrônica do átomo e dos cátions mais comuns desse elemento, é correto afirmar que
Dentre os halogênios, considere o flúor, o cloro, o bromo e o iodo. Sobre esses elementos, analise as afirmativas a seguir.
I. Quanto maior o raio atômico do halogênio, menor a sua energia de ionização. II. O halogênio de maior densidade, entre os citados, é o iodo. III. O cloro é um gás a 25°C e 1 atm.
Está correto o que se afirma em
O número de moléculas desse gás lançadas por ano na atmosfera é de, aproximadamente,
Leia o texto:
O “sal marinho”, por não passar pelo processo químico do sal comum, tem uma quantidade menor de aditivos químicos como conservantes e corantes associados ao desenvolvimento de câncer. Ele mantém maior quantidade de minerais como cálcio, potássio, ferro, zinco e iodo.
O Globo, 16.3.2023, p.23.
Assinale a opção em que todos os elementos citados formam
naturalmente cátions bivalentes.
I.A água pesada (D2O) é uma forma de água onde os átomos de hidrogênio são substituídos por deuterium, um isótopo do hidrogênio.
II.A densidade do gelo de D2O é quase idêntica à densidade da água líquida de D2O.
III.O ponto de fusão do gelo de água pesada (D2O) é maior que o do gelo de água comum (H2O).
É correto o que se afirma em:
( ) Sommerfeld propõe que a energia do elétron seria determinada pela distância em que ele se encontra do núcleo e pelo tipo de órbita que descreve.
( ) Hantaro Nagaoka, em 1903, sugeriu um modelo atômico formado por pares de cargas positivas e negativas, aos quais chamou de “dinamidas”. E estes pares de cargas ficariam em blocos flutuantes no espaço.
( ) Em 1904, Philipp Lénard publicou no Japão uma descrição do carbono, bem moderna para época, ele sugeriu que o átomo era constituído de um anel de elétrons ao redor de um centro muito denso.
Assinale a alternativa que apresenta a sequência correta de cima para baixo.