Questões de Concurso
Sobre teoria atômica: átomos e sua estrutura - número atômico, número de massa, isótopos, massa atômica em química
Foram encontradas 382 questões
O átomo é um sistema eletronicamente neutro, onde o número de prótons é igual ao número de elétrons. A distribuição dos elétrons faz-se por divisão em sete camadas ao redor do núcleo: K, L, M, N, O, P, Q.
Fonseca, Albino. Ciências, 9° ano. 3. ed. São Paulo: IBEP, 2013
O átomo é um sistema eletronicamente neutro, onde o número de prótons é igual ao número de elétrons. A distribuição dos elétrons faz-se por divisão em sete camadas ao redor do núcleo: K, L, M, N, O, P, Q.
Fonseca, Albino. Ciências, 9° ano. 3. ed. São Paulo: IBEP, 2013
O átomo é um sistema eletronicamente neutro, onde o número de prótons é igual ao número de elétrons. A distribuição dos elétrons faz-se por divisão em sete camadas ao redor do núcleo: K, L, M, N, O, P, Q.
Fonseca, Albino. Ciências, 9° ano. 3. ed. São Paulo: IBEP, 2013
As camadas N e O são aquelas que podem
apresentar os maiores números de elétrons, no
quantitativo de 24 elétrons.
I. A massa atômica de um elemento químico é a média ponderada das massas dos seus isótopos naturais, levando em consideração suas abundâncias relativas.
II. A massa molecular de uma substância é a soma das massas atômicas dos elementos que compõem uma molécula dessa substância, e ela sempre deve ser expressa em unidades de gramas.
III. A massa atômica do carbono-12 é exatamente 12 unidades de massa atômica (u), e este valor é utilizado como padrão para definir a unidade de massa atômica.
IV. Em uma molécula de dióxido de carbono (CO₂), a massa molecular é a soma das massas atômicas de dois átomos de oxigênio e um átomo de carbono.
V. A massa atômica do cloro é aproximadamente 35,5 u, refletindo a existência de dois isótopos principais do cloro, Cl35 e Cl-37, com a mesma abundância.
Marque a opção que apresenta as afirmativas CORRETAS.
Dados: densidade Hg(l) = 13,6 kg/dm3 ; massa molar Hg = 200 g/mol; considere o número de Avogadro = 6 x 1023
Para os átomos isótopos 2x+7A68 e 3x-5B70, o número atômico é:
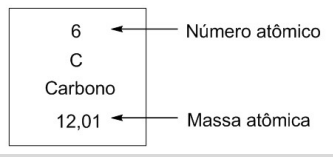
Essa diferença de massa atômica para o carbono pode ser atribuída à
As configurações eletrônicas do átomo de níquel no estado fundamental e do íon Ni2+ correspondem, respectivamente, a
De acordo com os conceitos que abarcam a estrutura da matéria, as transformações químicas e a matéria em seus diferentes estados, julgue (C ou E) o item a seguir.
Os elétrons em um átomo têm carga negativa e estão incrustados no núcleo positivo.
Os números quânticos são números atribuídos aos elétrons em um átomo para descrever as suas características orbitais. Eles incluem o número quântico principal (n), o número quântico secundário (1), o número quântico magnético (m) e o spin quântico (s). Esses números determinam a energia, o formato e a orientação das órbitas eletrônicas em tomo do núcleo de um átomo. Identifique o átomo com os seguintes números quânticos:
número quântico principal (n) = 3
número quântico secundário (1) = 2
número quântico magnético (m) =-1
número quântico spin (s) = +1/2
A distribuição eletrônica corresponde a forma com que os elétrons de um átomo ou íon são organizados, levando em conta seu número atômico ou número final de elétrons e seus respectivos orbitais. Sabendo que o primeiro elétron adicionado na organização apresenta spin -1/2, marque a alternativa que possui o único conjunto de características que corresponde ao respectivo orbital, de modo que está esquematizado na seguinte ordem os números quânticos: principal, azimutal, magnético e spin.
Mendelev foi quem efetivamente conseguiu fazer a organização que englobou o maior número de elementos químicos, nascendo assim a primeira tabela periódica dos elementos. Entretanto, a tabela de Mendelev não era perfeita, pois alguns elementos não se encaixavam na coluna em que foram colocados.
Fonte: Fernando Gewandsnadjer. Ciências − matéria e energia, 9. São Paulo: Editora ática, 2016.
Portanto, tempos depois, o cientista Moseley descobriu que algumas irregularidades da tabela de Mendelev poderiam ser corrigidas quando:
Assinale a alternativa CORRETA.
Julgue o item que se segue.
A sequência dos átomos Te, Bi e Rb está coerente com
os valores, na ordem decrescente, de seus raios
atômicos.
( ) Em 1913, Bohr propôs um modelo no qual os elétrons orbitam o núcleo, porém com uma órbita definida e particular. Bohr conhecia os trabalhos de Planck e Einstein. Em seu modelo, os elétrons ocupam estados estacionários de energia fixa. Os elétrons podem realizar saltos quânticos de um estado de energia para outro em que é liberado um fóton.
( ) O físico inglês J. J. Thomson usou o tubo de raios catódicos e seu conhecimento da teoria eletromagnética para determinar a razão entre a carga elétrica e a massa de um elétron.
( ) O modelo atômico de Dalton propôs que a matéria é constituída de minúsculas partículas, como uma minúscula esfera maciça, impenetrável, indestrutível, indivisível e sem carga.
( ) Thomson propôs que um átomo podia ser imaginado como uma esfera com carga positiva uniforme de matéria, na qual os elétrons estão embutidos como passas em um bolo. Esse modelo chamado de “pudim de passas” foi a teoria aceita durante muitos anos.
A ordem correta de preenchimento dos parênteses, de cima para baixo, é: