Questões de Concurso
Sobre teoria atômica: modelo atômico de dalton, thomson, rutherford, rutherford-bohr em química
Foram encontradas 175 questões


Com relação ao assunto abordado nos textos, assinale a opção correta.
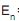 = –72,0/n2 , onde n é o número quântico principal. Considere a constante de Planck h = 4,14 × 10–15 e V.s e a velocidade de propagação da onda eletromagnética no vácuo c = 3,00 × 108 m/s. O comprimento de onda, em nm, de fótons provenientes da transição do nível n = 3 para o nível n = 2, propagando-se em um meio onde o índice de refração vale 2,00, é
= –72,0/n2 , onde n é o número quântico principal. Considere a constante de Planck h = 4,14 × 10–15 e V.s e a velocidade de propagação da onda eletromagnética no vácuo c = 3,00 × 108 m/s. O comprimento de onda, em nm, de fótons provenientes da transição do nível n = 3 para o nível n = 2, propagando-se em um meio onde o índice de refração vale 2,00, éI – Os raios catódicos são atraídos por uma chapa metálica ligada ao polo positivo de uma bateria.
II – A mudança dos gases no interior dos tubos não afeta a razão carga/massa dos raios catódicos.
III – A razão carga/massa dos raios canais é dependente do gás presente no interior das ampolas.
IV – Ao inverter a ligação dos polos da fonte com os eletrodos das ampolas, os raios catódicos se transformam em prótons.
Estão corretas APENAS as afirmativas
Acerca desse assunto, julgue os itens.
Acerca desse assunto, julgue os itens.
Com relação a esse assunto, julgue os itens.
Com relação a esse assunto, julgue os itens.
Átomo é a menor partícula em que um elemento pode ser dividido e que ainda apresente as propriedades do elemento em questão.
Uma transição eletrônica envolve a transferência de um elétron de um orbital para outro. Tanto os átomos (orbitais atômicos) como as moléculas (orbitais moleculares) podem sofrer esse tipo de transição. A diferença de energia entre os orbitais 3s e 3p para o átomo de sódio é de 2,107 eV. Indique qual o comprimento de onda da radiação que será absorvida ao se excitar um elétron de um orbital 3s para o orbital 3p.
Dados:
Constante de Planck (h)=6,63 x 10-34 J s
1eV = 1,60 x 10-19 J)
O nitroprussiato de sódio — Na2[Fe(CN)5NO] — é um composto empregado como fonte de óxido nítrico — um potente vasodilatador — administrado por via intravenosa em pacientes em situação de emergência hipertensiva. O uso inadequado desse medicamento, que é sensível à luz e que produz cianeto em sua decomposição, pode causar morte acidental por déficit de oxigênio no organismo.
Com base nas informações apresentadas, julgue o próximo item.
Caso todos os ligantes desse composto fossem substituídos por
íons Br–
, o ânion gerado seria o hexabromoferrato(III), que
absorve radiação em comprimento de onda maior que o
absorvido pelo Na2[Fe(CN)5NO].