Questões de Concurso
Sobre teoria atômica: modelo atômico de dalton, thomson, rutherford, rutherford-bohr em química
Foram encontradas 179 questões
As cores brilhantes observadas durante a queima de fogos de artifício são geradas a partir de elementos metálicos presentes nos fogos. Por exemplo, sais de estrôncio, como o SrCrO4, dão origem à luz vermelha; sais de cobre, como o Cu(NO3)2, à luz verde; sais de magnésio, como MgCl2, à luz branca.
Sabendo que esse fenômeno pode ser explicado com base na estrutura eletrônica dos diferentes elementos metálicos, julgue o próximo item.
De acordo com o modelo atômico de Rutherford-Bohr, quando
aquecidos, diferentes elementos químicos geram diferentes
cores porque emitem radiação contínua.
Amostras de água residual foram coletadas para análises de nitrogênio amoniacal (frasco I), metais (frasco II) e fósforo total (frasco III). Aos frascos I, II e III foram adicionadas soluções para a preservação da amostra.
As soluções adequadas para a preservação das amostras visando à determinação desses analitos nos frascos I, II e III são, respectivamente,
Entre eles houve um modelo que descreve o átomo como um núcleo pequeno, carregado positivamente e cercado por elétrons em órbita circular, que é denominado de:
A constituição da matéria está presente no vocabulário científico desde a Grécia antiga, mas sem comprovação científica, apenas filosófica. Como conhecimento científico os modelos atômicos foram formulados a partir de 1808 e à medida que novos e melhores métodos de investigação foram sendo desenvolvidos, evoluídos. A seguir, são apresentadas as representações gráficas de alguns modelos atômicos:
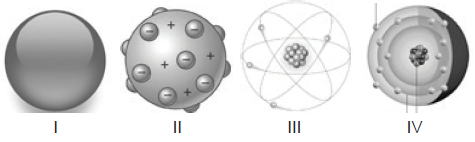
Julgue os itens a seguir:
( ) Dalton, figura I, tomou como base para o desenvolvimento de seu modelo atômico análises de conservação e proporcionalidade da massa em uma reação, originárias de Lavoisier e Proust.
( ) O modelo atômico de Thomson , figura II, apresenta a ideia de descontinuidade pela primeira vez e apresenta a primeira subpartícula atômica encontrada: o elétron.
( ) A figura III representa o modelo atômico de Rutherford, destacando o surgimento da ideia de núcleo positivo, sem os nêutrons que só seriam descobertos por Sommerfeld em 1932.
( ) A figura IV representa o átomo de Chadwick, organizando os níveis de energia eletrônicos pela primeira vez.
Assinale a alternativa que contém a análise correta em verdadeiro (V) e falso (F) para os itens apresentados.
No estudo dos modelos atômicos, a hipótese atômica de John Dalton (1766-1844) é trazida para sala de aula dando base à discussão sobre a constituição da matéria.
Para o desenvolvimento do trabalho sobre o modelo de Dalton é importante a discussão sobre
Nos fogos de artifício, no momento em que a pólvora explode, a energia excita os elétrons dos átomos que mudam de níveis de energia. Essa movimentação eletrônica é marcada pela emissão de luz colorida. Esse fenômeno é explicado pelo modelo atômico de Bohr.
Com base nos postulados do modelo atômico descrito no enunciado, pode-se aferir que
O modelo para o átomo proposto por Thomson está representado abaixo.
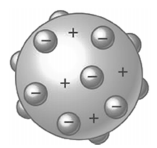
(http://www.explicatorium.com/images/modelo-Thomson.jpg. Acesso em 03/01/2016)
Com esse modelo, Thomson interpretou
A Teoria do Orbital Molecular (TOM) permite prever a existência de espécies, como íons moleculares,sua estabilidade relativa e algumas propriedades. Entretanto a TOM não prevê a existência da espécie He2. Porém essa espécie existe apenas à temperatura de 4,5 K, possuindo comprimento de ligação de 52 angstrons e energia de ligação de 9,63x10-3J mol-1 determinados experimentalmente. Com base na TOM,avalie as afirmações a seguir.
Dado He (Z = 2)
I. A espécie He2 possui ordem de ligação igual a zero e é estável.
II. Ordem de ligação no íon molecular He2+é menor que no dímero de hélio
III. O comprimento de ligação do He2+é menor que do He2.
IV. As energias dos orbitais moleculares 1σg e 1σu do He2+e H2+ são as mesmas.
Assinale a alternativa que apresenta somente as afirmações CORRETAS:
Abaixo estão várias configurações eletrônicas que podem estar corretas para o átomo de nitrogênio (Z = 7). Os elétrons são representados por setas cuja direção indica o valor do número quântico spin, ms. Os três círculos para os orbitais p indicam os possíveis valores para o número quântico magnético, ml. Os estados podem ser classificados como fundamental se a configuração eletrônica representa o estado fundamental do átomo de nitrogênio, excitado se a configuração representa um possível estado excitado, ou proibido, se a configuração não pode existir.
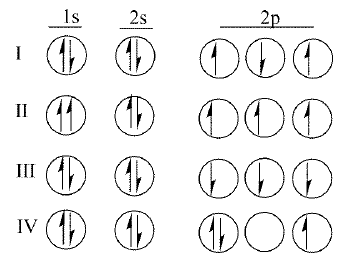
A classificação dos estados representados nas configurações de I a IV, nesta ordem, é:
Após estabelecidos os postulados que definiram os modelos atômicos de Dalton a Borh, outros cientistas contribuíram com as teorias relacionadas à a natureza quântica dos elétrons nos orbitais e na eletrosfera. Dentre essas teorias, destacam-se o Princípio da Exclusão de Pauli (1), o Princípio da Incerteza de Heisenberg (2) e a Equação de Onda de Schrödinger (3).
Dentre as opções a seguir, marque a que apresenta, na respectiva ordem das teorias, os conceitos e/ou postulados corretamente relacionados.
“Após a descoberta do elétron, não seria possível ainda conceber um átomo como uma esfera rígida, indivisível, mas como uma esfera ou nuvem de carga positiva, na qual os elétrons estariam embebidos, uniformemente distribuídos.”
Esse conceito de átomo é atribuído a
O diagrama de níveis de energia da molécula F2 está ilustrado a seguir. Os OM’s foram numerados segundo a ordem crescente de suas energias; as linhas tracejadas indicam a origem de cada um.
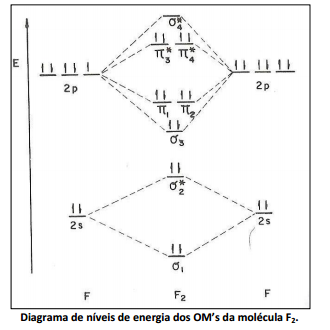
Com relação ao diagrama de níveis de energia dos OM’s da molécula F2 analise as afirmativas a seguir.
I. A expressão algébrica para combinação δ3 = 2pz – 2pz.
II. Aplicando‐se o princípio da edificação à molécula F2 obtém‐se a configuração eletrônica KK (δ1) 2 (δ2 * ) 2 (δ3) 2 (π1) 2 (π2) 2 (π3 * ) 2 (π4 * ) 2 . KK indica os elétrons internos, do nível quântico n = 1.
III. OL é igual a 2.
Está(ão) correta(s) apenas a(s) afirmativa(s)
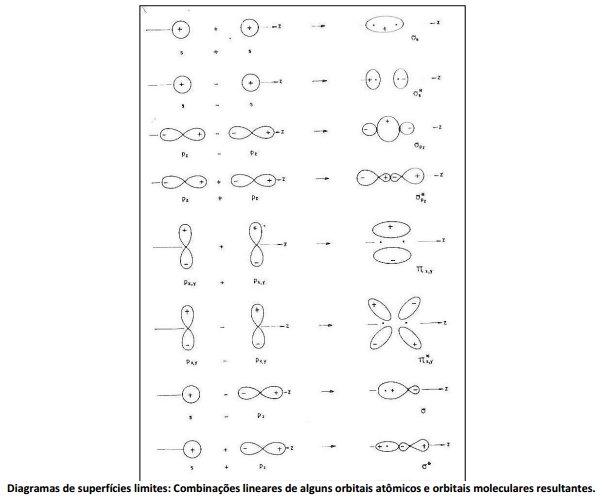
Sobre a figura, analise as afirmativas a seguir. I. As regiões nodais já existentes nos OA’s persistem nos OM’s. II. Toda vez que há uma região nodal, a função de ondas não muda de sinal. III. Qualquer orbital molecular antiligante possui um plano nodal perpendicular ao eixo internuclear e situado entre os núcleos. Está(ão) correta(s) apenas a(s) afirmativa(s)