Questões de Concurso
Comentadas sobre termoquímica: energia calorífica, calor de reação, entalpia, equações e lei de hess. em química
Foram encontradas 334 questões
C10H8 + O2 → CO2 + H2O
Considerando que uma massa m de naftaleno foi queimada em uma bomba calorimétrica (V constante) de capacidade calorífica Cc, (J/°C), indicando uma variação de temperatura Δt (°C), e que os gases são ideais e o volume dos sólidos e líquidos é desprezível, assinale a alternativa que apresenta corretamente a expressão da variação de entalpia de combustão (ΔH) do naftaleno.
Dados: MM (naftaleno) = 128 g/mol; P = pressão (kPa); V = volume (L); R = constante universal dos gases perfeitos (J/mol.K); T = temperatura absoluta (K); e ΔH = ΔU + (PV), em que ΔU é a variação da energia interna do sistema (J).
Considere as seguintes equações termoquímicas:
1. 2H2 + O2 → 2H2O; ∆H = - 600 kJ/mol
2. C + O2 → CO2; ∆H = - 400 kJ/mol
3. C + 2H2 → CH4; ∆H = + 75 kJ/mol
Qual o ∆H da reação CH4 + 2O2 → CO2 + 2H2O?
Leia o caso a seguir.
Em um dia frio, J. decide preparar um café quente para se aquecer. Utilizando um método tradicional, J. aquece água em um fogão até ferver (100 °C) e, em seguida, a despeja em uma caneca contendo café moído. A mistura de água quente e café resulta em uma bebida com temperatura final específica.
Informações adicionais:
• Massa da água: 100 g;
• Temperatura inicial da água: 100 °C;
• Massa do café moído: 50 g;
• Temperatura inicial do café moído: 25 °C;
• Calor específico da água: 4 J/g·°C;
• Calor específico do café moído: 2 J/g·°C;
• Assume-se que não há perda de calor para o ambiente durante o processo de mistura.
Com base nos conceitos de termoquímica e nos princípios
da conservação da energia, qual é a temperatura final da
mistura de café?
Acerca da termoquímica, julgue o item subsequente.
Uma reação reversível que seja exotérmica em um sentido
será endotérmica no sentido oposto; se uma reação química
libera calor, ela é exotérmica; se, durante uma reação
química, calor é absorvido do meio, então a reação em
questão é endotérmica.
Acerca da termoquímica, julgue o item subsequente.
O valor calorífico de um combustível é medido a partir do
calor de absorção que ele apresenta.
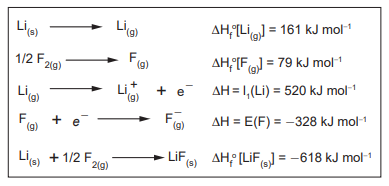
Nesse contexto, o valor aproximado da entalpia de rede (ΔHrede) para o LiF(s), em kJ mol-1 , é

Internet:<www.tabelaperiodica.org>
Acerca da espectroscopia de absorção molecular no ultravioleta e no visível, julgue o item.
À medida que o número de moléculas capazes de absorver luz de um determinado comprimento de onda aumenta, a extensão dessa absorção diminui, de acordo com a Lei de Lambert‑Beer expressa pela equação a seguir.
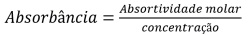
No que se refere à modificação de superfícies, julgue o seguinte item.
A funcionalização de superfícies antimicrobianas é uma
tecnologia que pode ser utilizada para desinfecção em vários
ramos da atividade humana, por exemplo, na esterilização de
dispositivos médicos para prevenir infecções hospitalares.
Julgue o item que se segue.
Em geral, a energia de ionização aumenta da esquerda
para direita na tabela periódica. No caso do átomo de
oxigênio, essa energia é menor do que a do átomo de
nitrogênio. Essa discrepância ocorre devido à repulsão de
um par de elétrons do oxigênio presentes em um dos
orbitais p.
Julgue o item que se segue.
O grafite e o diamante são alótropos do carbono. As
propriedades desses materiais são muito diferentes,
apesar de eles conterem apenas átomos de carbono.
Essas diferenças se devem ao fato de os átomos de
carbono apresentarem as hibridizações do tipo sp² no
diamante, e do tipo sp³ no grafite.
( ) A variação de entalpia (ΔH) de um sistema informa a quantidade de calor trocado por esse sistema à pressão constante. O sinal de ΔH informa se o processo é exotérmico ΔH>0 ou endotérmico ΔH<0.
( ) A representação de uma equação termoquímica deve incluir os coeficientes estequiométricos de todos os participantes e o ΔH do processo.
( ) A entalpia padrão de formação (ΔH0f) é positiva para as substâncias simples, desde que estejam no estado-padrão, no estado físico e na variedade alotrópica mais estável.
( ) Os valores ∆H são numericamente iguais, mas de sinais opostos, para reações químicas que sejam o inverso uma da outra.
A ordem correta de preenchimento dos parênteses, de cima para baixo, é:
XCO3(s) → XO(s) + CO2(g)
Considerando-se a pureza do carbonato e a sua decomposição assumidamente completa, o elemento X em questão é o
Na Tabela a seguir, são apresentados três alcenos isômeros.
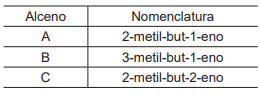
A representação em ordem crescente de energia liberada na combustão de 1 mol do alceno é a seguinte
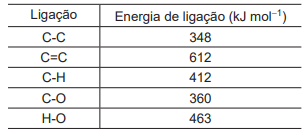
A variação de entalpia, em kJ mol-1 , da reação correspondente a esse processo industrial é
I - C (s) + H2 O (v) → CO (g) + H2 (g) ∆H° = -28.000 cal mol-1 II - CO (g) + H2 O (v) → CO2 (g) + H2 (g) ∆H° = +9.400 cal mol-1 III - C (s) + 2 H2 O (v) → CO2 (g) + 2 H2 (g)
Considerando-se essas informações, a variação de entalpia, em cal mol-1 , da equação termoquímica III é
CaCO3(s) → CaO(s) + CO2(g); ΔH0 = +179 kJ
Considerando-se o comportamento ideal do gás e o rendimento máximo da reação, a energia necessária, em MJ, para produzir 36 m3 de CO2 , medido nas condições normais de temperatura e pressão (CNTP) é, aproximadamente,
Dado R × T = 24,4 atm L mol-1 M = 106
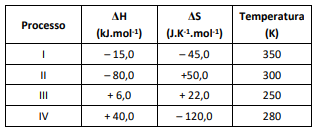
O processo espontâneo é o
Qual o valor mais próximo, em quilojoules, da energia liberada nesse processo?