Questões de Concurso
Comentadas sobre termoquímica: energia calorífica, calor de reação, entalpia, equações e lei de hess. em química
Foram encontradas 334 questões
Cgrafite + O2 (g) → CO2 (g) ∆H = – 393,5 kJ mol–1
Cdiamante + O2 (g) → CO2 (g) ∆H = – 395,4 kJ mol–1
Qual a variação de entalpia necessária, em quilojoules para converter um mol de grafite em diamante?
Com relação às mudanças de estado físico da matéria e à calorimetria, julgue o item subsequente.
Se não existir matéria como meio de propagação, não é
possível a transferência de calor.
Com relação às mudanças de estado físico da matéria e à calorimetria, julgue o item subsequente.
A capacidade térmica de um corpo consiste na quantidade de
calor que ele necessita ceder ou receber para variar sua
temperatura em 1 grau, sendo diretamente proporcional
à sua massa.
Com relação às mudanças de estado físico da matéria e à calorimetria, julgue o item subsequente.
Além dos estados sólido, líquido e gasoso, há o plasma, que
é a condição da matéria associada a partículas muito
energizadas, com certo distanciamento e nenhuma ou pouca
ligação entre si, e cujas propriedades são semelhantes às do
estado líquido, mas com uma energia cinética maior.
Com relação às mudanças de estado físico da matéria e à calorimetria, julgue o item subsequente.
As mudanças de estado de líquido para gasoso podem ser
corretamente chamadas de evaporação, ebulição e calefação,
as quais se diferenciam principalmente pela velocidade em
que ocorrem.
Cr2O72- + 14 H+ + 6 Fe2+ → 2 Cr3+ + 6 Fe3+ + 7 H2O
50,00mL de amostra, livre de interferentes, foi tratada com 25,00mL de solução de K2Cr2O7 com concentração igual a 0,04167mol.L-1 , além de H2SO4 e Ag2SO4. A titulação do excesso de dicromato na amostra consumiu 12,50mL de solução de sulfato ferroso amoniacal 0,2500mol.L-1 . A titulação do branco consumiu 25,00mL de solução de sulfato ferroso amoniacal 0,2500mol.L-1 .
Dado: Massa molar de O2 = 32,00 g.mol-1 .
A DQO da amostra, expressa em mgO2 L-1 , é igual a
C3H8(g) + 5 O2(g) ⇌ 3 CO2(g) + 4 H2O(l) ΔHc° = 2.220 kJ
Tendo as informações precedentes como referência inicial, julgue o próximo item.
A entalpia de formação do propano pode ser obtida pela diferença entre ΔHc° e a soma das entalpias padrão de formação dos produtos da reação de combustão mostrada.
Calcule a variação de entalpia quando 72 g de gelo se fundem.
Considere: ΔH fus= 6009,5 J/mol
H0 = pKa(BH+) - log [BH+] / [B]
onde B é um indicador básico, BH+ é o ácido conjugado desse indicador e pKa(BH+) é a constante de acidez deste último. Quando o indicador é nitroanilina (C6H6N2O2), experimentos realizados para ácidos puros nas mesmas condições, permitem construir a tabela abaixo:
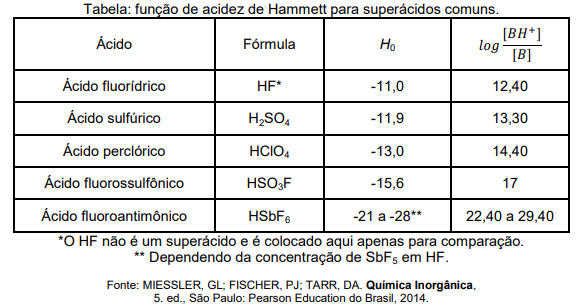
Diante dessas informações, assinale a opção que mostra a ÚNICA reação termodinamicamente espontânea entre pares das substâncias citadas acima:
A variação de entalpia da reação de produção do carbureto de cálcio é igual a
Dados: Massas molares (g.mol-1 ): H=1; C =12; N=14.
A variação de entalpia da reação apresentada, em kJ, é
A tabela a seguir apresenta os valores de energias das ligações:
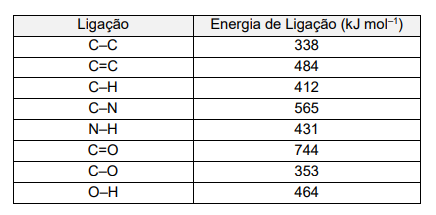
Utilizando os valores das energias das ligações fornecidos, a variação de entalpia envolvida na transformação da fenilalanina em ácido cinâmico representada, em kJ mol-1 , corresponde a:
No que se refere às escalas de temperatura, julgue o item subsequente.
A temperatura pode ser determinada por uma escala
padronizada, equivalente ao conceito de energia do
movimento molecular. O zero absoluto é uma temperatura
em que o movimento das moléculas cessa, sendo esse valor,
na escala absoluta, ou escala Kelvin, igual a −273 K. Na
escala Kelvin, a temperatura absoluta é inversamente
proporcional à energia cinética média de translação das
moléculas de um gás.
Com relação à termoquímica, julgue o item que se segue.
A termoquímica é o ramo da química que estuda os calores
de reações e assuntos relacionados. As reações químicas
endotérmicas ocorrem com libertação de calor, ao passo que
as reações exotérmicas ocorrem com absorção de calor. Os
produtos da queima de combustíveis ao ar são muito quentes,
assim, tal reação é fortemente endotérmica, pois a
temperatura dos produtos é mais elevada que a dos
reagentes.
Com relação à termoquímica, julgue o item que se segue.
A combustão é uma reação química em que a substância
simples ou o composto queima na presença de oxigênio,
produzindo-se CO2 e H2O. Nesse sentido, somente
substâncias orgânicas sofrem combustão.