Questões de Concurso
Comentadas sobre transformações químicas e energia em química
Foram encontradas 366 questões
Na titulação representada pela equação seguinte, o potencial no ponto de equivalência é igual à média aritmética dos potenciais padrão de redução dos dois pares redox envolvidos na reação.
U4+ + 2 Ce4+ + 2 H2O ⇌ UO2 2+ + 2 Ce3+ + 4 H+
C3H8(g) + 5 O2(g) ⇌ 3 CO2(g) + 4 H2O(l) ΔHc° = 2.220 kJ
Tendo as informações precedentes como referência inicial, julgue o próximo item.
A entalpia de formação do propano pode ser obtida pela diferença entre ΔHc° e a soma das entalpias padrão de formação dos produtos da reação de combustão mostrada.
Nos estudos de Alessandro Volta, que tomou como base os experimentos e as teorias de Galvani, foram utilizados diferentes discos de metais (Cu/Sn ou Zn/Ag) empilhados e conectados com pedaços de papel umedecidos em solução salina. Dessa maneira, o cientista conseguiu encontrar o método para a geração de corrente elétrica e estabeleceu evidências para a existência da eletricidade por meio da construção da pilha — cujo nome vem do empilhamento dos discos. Na tabela a seguir, são mostrados os potenciais padrão de redução de algumas espécies químicas em água.

Na célula eletroquímica representada a seguir, ocorre redução do hidrogênio.
Pt(s), H2(g) | HCl(aq) ‖ Hg2Cl2(s) | Hg(l)
Nos estudos de Alessandro Volta, que tomou como base os experimentos e as teorias de Galvani, foram utilizados diferentes discos de metais (Cu/Sn ou Zn/Ag) empilhados e conectados com pedaços de papel umedecidos em solução salina. Dessa maneira, o cientista conseguiu encontrar o método para a geração de corrente elétrica e estabeleceu evidências para a existência da eletricidade por meio da construção da pilha — cujo nome vem do empilhamento dos discos. Na tabela a seguir, são mostrados os potenciais padrão de redução de algumas espécies químicas em água.

Em uma pilha cujo eletrodo padrão de hidrogênio fosse acoplado a uma semicélula que contivesse o eletrodo de cobre, o hidrogênio funcionaria como cátodo da pilha.
Nos estudos de Alessandro Volta, que tomou como base os experimentos e as teorias de Galvani, foram utilizados diferentes discos de metais (Cu/Sn ou Zn/Ag) empilhados e conectados com pedaços de papel umedecidos em solução salina. Dessa maneira, o cientista conseguiu encontrar o método para a geração de corrente elétrica e estabeleceu evidências para a existência da eletricidade por meio da construção da pilha — cujo nome vem do empilhamento dos discos. Na tabela a seguir, são mostrados os potenciais padrão de redução de algumas espécies químicas em água.

A partir do texto apresentado, julgue o item seguinte.
É correto concluir que, na pilha montada por Alessandro
Volta, a quantidade de cobre metálico aumentou e a
concentração de íons Zn+2 diminuiu na solução ao longo da
reação.
O2 + 2 Pb → 2 PbO 2 PbO + 2 H2SO4 → 2 PbSO4 + 2 H2O 2 PbSO4 + 4 H+ + 4 e– → 2 Pb + 2 H2SO4 2 H+ + 2 e– → H2
Considerando o fenômeno exposto, assinale a alternativa que apresenta a ddp (ΔE0) gerada na recombinação do O2 com o H2.
Dados:

Calcule a variação de entalpia quando 72 g de gelo se fundem.
Considere: ΔH fus= 6009,5 J/mol
Um dos radionuclídeos do Radônio é 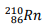 que decai emitindo
partículas alfa (α) para um dos isótopos do Polônio.
que decai emitindo
partículas alfa (α) para um dos isótopos do Polônio.
Uma reação que representa esse processo de desintegração nuclear é dada por:
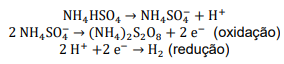
A hidrólise do persulfato de amônio forma H2O2:
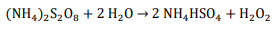
Se a eficiência do processo eletrolítico é de 60% assinale a opção que mostra a INTENSIDADE DE CORRENTE necessária para produzir 97 g de H2O2 por hora: Dados eventualmente necessários: constante de Faraday = 96500 C/mol; massas molares (g/mol): N = 14; O = 16; H = 1; S = 32.
H0 = pKa(BH+) - log [BH+] / [B]
onde B é um indicador básico, BH+ é o ácido conjugado desse indicador e pKa(BH+) é a constante de acidez deste último. Quando o indicador é nitroanilina (C6H6N2O2), experimentos realizados para ácidos puros nas mesmas condições, permitem construir a tabela abaixo:
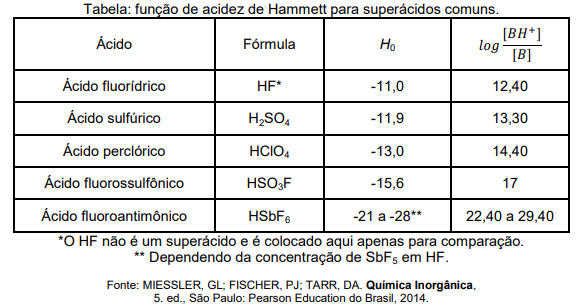
Diante dessas informações, assinale a opção que mostra a ÚNICA reação termodinamicamente espontânea entre pares das substâncias citadas acima:
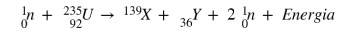
Na reação apresentada, o número atômico de X e o número de massa de Y são, respectivamente,
O alumínio é comumente encontrado na natureza formando minerais, como a criolita (Na3AℓF6). Esse mineral apresenta brilho vítreo e sua cor varia de incolor a branco.
Um processo industrial que utiliza a eletrólise ígnea da criolita, usa uma carga de 1 x 106 Faradays.
Nesse processo, a quantidade de alumínio metálico produzido corresponde, aproximadamente, a
Dados: 1F = 96500C, Massa molar Aℓ = 27 g.mol–1
A variação de entalpia da reação de produção do carbureto de cálcio é igual a
Dados: Massas molares (g.mol-1 ): H=1; C =12; N=14.
A variação de entalpia da reação apresentada, em kJ, é
Considerando que a meia-vida desse radioisótopo é de 13,0 horas, a quantidade que sofreu desintegração, após 2 dias e 4 horas, de uma amostra com 12,00mg de acetato de cobre(II) será, aproximadamente, de
Admitindo-se que essas espécies possam estar participando do processo responsável pelo acendimento do LED, que opera entre 1,5 e 2,7 V, a possível pilha formada envolve:
A variação de energia livre relacionada à reação de combustão do etanol, apresentada pela equação a seguir, é mais próxima do comportamento descrito pela seguinte letra (correspondente no gráfico):
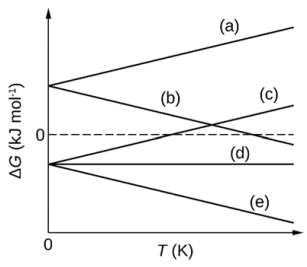
C2H5OH(l) + 3O2(g) → 2CO2(g) + 3H2O(g)