Questões de Química - Transformações Químicas e Energia para Concurso
Foram encontradas 1.424 questões
Considerando a constante de Faraday igual a 96.500 C/mol e as informações apresentadas acima, julgue o próximo item.
A formação de 2,0 g de sódio metálico deve ser acompanhada pela formação de uma massa superior a 4,0 g de Cl2.
Considerando a constante de Faraday igual a 96.500 C/mol e as informações apresentadas acima, julgue o próximo item.
No processo, sabendo que M(Na) = 23 g/mol, a circulação de uma corrente elétrica igual a 2,0 A em um intervalo de 4.825 s deve produzir uma massa superior a 2,0 g de sódio metálico.
Considerando a constante de Faraday igual a 96.500 C/mol e as informações apresentadas acima, julgue o próximos item.
O potencial elétrico mínimo (E) que deve ser aplicado à célula eletrolítica para que ocorra a eletrólise do NaCl pode ser calculado pela equação E = E (Na+/Na) + 2E (Cl2/ Cl- ) , em que E ( Na+ /Na ) e E(C12 /Cl- ) são, respectivamente, os potenciais elétricos de redução dos pares Na+/Na e Cl2/Cl- na temperatura do experimento.
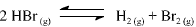
Com base nessas informações, julgue o item que se segue.
A partir dos valores da constante de equilíbrio fornecidos, é correto afirmar que a reação de decomposição do HBr(g) em H2 (g) e Br2 (g) é endotérmica.
Os dados da tabela acima se referem a testes realizados, a 298 K, utilizando-se o método das velocidades iniciais, para determinação da lei de velocidade para a reação do BO3-(aq) com o Br-(aq) em meio ácido. A equação não balanceada para essa reação é a seguinte.
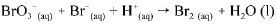
A respeito da reação acima e dos com postos nela envolvidos, e considerando as informações fornecidas, julgue o item que se segue.
A reação em questão pode ser considerada uma reação de oxi-redução.
