Questões de Química - Transformações Químicas e Energia para Concurso
Foram encontradas 1.424 questões
O palito de fósforo é um dos artigos mais úteis no nosso cotidiano. Na sua composição, possui fósforo vermelho, enxofre e clorato de potássio, além de resina para manter a mistura colada. A reação provocada pelo atrito da cabeça do palito de fósforo e a lixa, que inicia a queima, está representada ao lado.
A entalpia da reação mencionada em kilojoules por mol de P4 é:

Quimicamente, o gás bromo (Br2 ) pode reagir com gás hidrogênio (H2 ) sob aquecimento ou ação da luz, produzindo brometo de hidrogênio (HBr), cuja solução aquosa (ácido bromídrico) corresponde a um hidrácido muito forte.
Considere as equações termoquímicas a seguir.
NH3(g) + HBr(g) → NH4Br(s) H0 = –188,32 kJ
N2(g) + 3H2(g) → 2NH3 (g) H0 = –92,2 kJ
2NH4Br(s) → N2(g) + 4H2(g) + Br2(g) H0 = +541,66 kJ
Baseando-se nessas equações termoquímicas, é correto
afirmar que o valor aproximado da entalpia de reação da
síntese do gás brometo de hidrogênio é igual a:
Qual a energia livre (ΔG) aproximada para a reação da célula eletroquímica descrita abaixo? Cu ǀ Cu2+ (0,0100 mol L-1 ) ‖ Ag+ (0,0100 mol L-1 ) ǀ Ag
Dados potenciais padrão:
Eo (Ag+ /Ag) = +0,799V
Eo (Cu2+/Cu) = +0,337V
Ni2+(aq) + 2e-
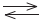 Ni(s) Eredo
= -0,28V
Ni(s) Eredo
= -0,28V A tensão teórica gerada por essa pilha é: