Questões de Concurso
Comentadas sobre transformações químicas: elementos químicos, tabela periódica e reações químicas em química
Foram encontradas 285 questões
O clorato de potássio (KClO3), quando aquecido, se decompõe segundo a equação química abaixo.
2 KClO3(s) → 2 KCℓ(s ) + 3O2(g)
Uma mistura com massa desconhecida contém apenas KCℓO3 e KCℓ e foi aquecida produzindo 0,175 mol do gás oxigênio proveniente da reação de decomposição completa do KCℓO3. Após o aquecimento, a massa final de KCℓ foi de 25,0 g.
Dessa forma, a massa total aproximada, em gramas, da mistura que foi aquecida era de
Dados
M(KCℓ) = 75 g mol-1
M (KCℓO3) = 123 g mol-1
Num experimento químico eram necessários 60 gramas de iodeto de cobre (I), mas este reagente estava em falta. Assim a solução do problema era fabricá-lo de acordo com a reação química a seguir:
KI(aq) + CuSO4(aq) → I2(s) + K2SO4(aq) + CuI(s)
Quantos gramas de sulfato de cobre (II) serão necessários para formar a quantidade exata de iodeto
de cobre (I)?
O ferro metálico pode ser obtido industrialmente por meio da seguinte reação não balanceada:
Fe2O3(s) + CO(g) → Fe(s) + CO2(g)
Considerando uma reação com transformação
total de produtos em reagentes, assinale a
alternativa correta sobre esse processo.
O carbonato de cálcio, CaCO3(s), decompõe-se com aquecimento para produzir CaO(s) e CO2(g). Uma amostra de CaCO3 é decomposta e o dióxido de carbono é coletado num frasco de 300 mL. Depois de completada a decomposição, o gás tem pressão de 1,5 atm à temperatura de 27°C. Qual é a quantidade aproximada de matéria, em mol de CO2, produzida na decomposição?
Dados:
R = 0,0821 L atm/K.mol
Massas molares (g/mol): C = 12; Ca = 40 e O = 16.
O processo de oxidação de minérios é comumente empregado para reduzir seu teor de carbono. Desse modo, qual é a massa de oxigênio, em kg, necessária para reduzir o teor de carbono de 5% para 2% em 50 toneladas de minério?

1 N2 (g) + 3 H2 (g) → 2 NH3 (g)
Dados: Massa Molar (N2 ) = 28 kg/kmol; Massa Molar (H2 ) = 2 kg/kmol. A vazão mássica de N2 na alimentação para produção de 1700 kg/dia de amônia é
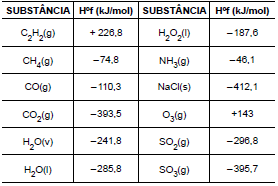
Com relação à classificação periódica e às propriedades químicas mais importantes dos elementos, julgue o item que se segue.
Os gases nobres são encontrados naturalmente como
gases diatômicos não reativos. O gás hélio, por exemplo,
é duas vezes mais denso que o ar atmosférico. Pelo fato
de não ser inflamável, ele é usado para encher balões e
dirigíveis.
Com relação à classificação periódica e às propriedades químicas mais importantes dos elementos, julgue o item que se segue.
O raio atômico, o raio iônico, a energia de ionização e a
afinidade eletrônica são algumas das propriedades
periódicas dos elementos.
Considerando os conceitos de átomo, estados da matéria e reações químicas, julgue o item seguinte.
Uma reação química é o processo de mudança química da matéria, isto é, a conversão de uma ou mais substâncias em outras substâncias.As cores brilhantes observadas durante a queima de fogos de artifício são geradas a partir de elementos metálicos presentes nos fogos. Por exemplo, sais de estrôncio, como o SrCrO4, dão origem à luz vermelha; sais de cobre, como o Cu(NO3)2, à luz verde; sais de magnésio, como MgCl2, à luz branca.
Sabendo que esse fenômeno pode ser explicado com base na estrutura eletrônica dos diferentes elementos metálicos, julgue o próximo item.
Entre os elementos metálicos citados (estrôncio, magnésio
e cobre), o magnésio é o que apresenta menor energia
de ionização.
A seguir, estão listados quatro métodos empregados para a separação de misturas de CH4 e CO2.
I Absorção por água pressurizada: baseia-se na maior solubilidade em água do CO2.
II Criogenia: o resfriamento gradual da mistura faz que o componente com maior ponto de ebulição se liquefaça primeiro.
III Separação por membranas: o componente com menor diâmetro crítico apresenta maior capacidade de permeação.
IV Adsorção física seletiva do CO2 por sólidos porosos, como os carbonos ativados: a presença de grupos funcionais básicos na superfície do adsorvente (como, por exemplo, os ilustrados na estrutura abaixo) favorece o processo.
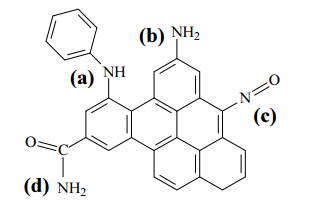
Considerando os métodos apresentados, julgue o item subsequente.
O CO2 é um óxido ácido que, ao se dissolver em água, pode com ela reagir para formar ácido carbônico, de acordo com a equação a seguir.
CO2 + H2O → H2CO3
A decomposição do carbonato de cálcio é representada por:
CaCO₃ (s) → CaO (s) + CO₂ (g)
Considerando as massas molares dos elementos carbono, oxigênio e cálcio, respectivamente, iguais a 12 g mol⁻¹,16 g mol⁻¹e 40 g mol⁻¹, julgue o item a seguir.
Na decomposição completa de 50 g de carbonato de
cálcio, obtém-se um resíduo sólido de CaO de massa
igual a 28 g.
Com relação aos conhecimentos de química inorgânica e suas aplicações, julgue o próximo item.
Na tabela periódica, os elementos estão apresentados
em ordem decrescente de volume atômico (volume
molar). Essa organização resulta em famílias de
elementos com propriedades químicas díspares
distribuídos em camadas na tabela periódica.
Uma indústria que fabrica suplemento mineral do tipo “fosfacálcio”, utilizado na alimentação de aves de postura, realiza processo em batelada. Ao reagir 500kg de calcário com teor de 80% em carbonato de cálcio, com solução suficiente de ácido fosfórico, produz monohidrogeno fosfato de cálcio.
A massa de sal produzida, em kg, é igual a
A nitroglicerina é um líquido oleoso de cor amarelo-pálido, muito sensível ao impacto. É um dos explosivos mais fortes que existem. Sua decomposição ocorre conforme mostra a equação a seguir:

Sobre os possíveis motivos que justificam seu alto poder explosivo, foram feitas as seguintes
afirmações:
I. A energia de ligação entre os átomos de Nitrogênio, assim como entre C e O e entre H e O, são muito fortes.
II. Os produtos gasosos aumentam a pressão, consequentemente, seu poder destrutivo.
III. O aumento do grau de desordem do sistema torna a equação altamente favorável, em acordo com a segunda lei da termodinâmica.
IV. Processos endotérmicos liberam grande quantidade de energia.
O Níquel metálico reage com o ácido clorídrico conforme a reação abaixo, não balanceada:
Partindo de 17,6g de Níquel e ácido clorídrico em excesso, a massa de cloreto de níquel III e o volume
de gás Hidrogênio liberado nas CNTP serão, respectivamente,
A análise da concentração de ortofosfato em corpos d’água pode ser feita utilizando o método colorimétrico. Nesse método, o reagente combinado contendo K(SbO)C4H4O6, (NH4)6Mo7O24 e ácido ascórbico reage em meio ácido com o ortofosfato, produzindo uma cor azul, cuja intensidade é determinada no espectrofotômetro.
No preparo de 100 mL do reagente combinado utiliza-se 5 mL de uma solução de K(SbO)C4H4O6 3,5 g.L-1 e 15 mL de uma solução de (NH4)6Mo7O24 40 g.L-1.
Nessa solução do reagente combinado as concentrações
aproximadas (em g.L-1 ) de K(SbO)C4H4O6 e de (NH4)6Mo7O24 são,
respectivamente,
