Questões de Concurso
Sobre transformações químicas: elementos químicos, tabela periódica e reações químicas em química
Foram encontradas 1.107 questões
Fonte: BBC Brasil, 2023. Disponível em: https://www.bbc.com/portuguese/articles/c7246ee619qo
Em relação às características físico-químicas e ambientais do mercúrio, podemos afirmar que:
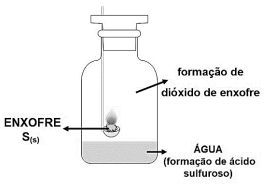
Certa quantidade de enxofre é inserida no dispositivo de combustão e a chama é iniciada no bico de Bunsen. Então, ainda com a chama acesa, o dispositivo é inserido em um frasco hermeticamente fechado e o dióxido de enxofre formado fica confinado no recipiente. Este gás, por sua vez, reage com a água contida no fundo do frasco, formando uma solução de ácido sulfuroso. Considerando todas as informações apresentadas e a imagem, a reação que expressa corretamente a formação do ácido sulfuroso é:
A respeito de estequiometria, processo de fabricação, corrosão e soldagem, julgue o item a seguir.
Considere-se que a reação para a produção de biodiesel ocorra a partir de 1 mol de triglicerídeo (TRIG) e 3 mols de metanol (MET), na presença de um catalisador (NaOH), para formar monoésteres de ácidos graxos (BIO = biodiesel) e 1 mol de glicerina (GLI), conforme a equação que se segue.
1 TRIG + 3 MET → BIO + 1 GLI
Com base nessa hipótese e considerando-se a massa molar
do metanol igual a 32 g/mol e a massa molar da glicerina
igual a 60 g/mol, é correto afirmar que, se forem utilizados
960 kg de metanol na presença de um excesso de
triglicerídeos, para um rendimento de 80% a massa
resultante de glicerina será de 480 kg.
Se uma peça de aço carbono que contém 5 g de ferro for completamente oxidada pelo H2S, serão formados mais de 8 g de mackinawita.
Com base nessas informações, julgue o próximo item.
A degradação do ozônio é uma reação de dissociação.
Com base nessas informações, julgue o próximo item.
A etapa II do mecanismo proposto, em que a molécula de
ozônio reage com o oxigênio atômico, é bimolecular.

Com base nessas informações, julgue o próximo item.
A degradação da dipirona ocorre por hidrólise.
A respeito da tabela periódica e dos modelos atômicos, julgue o item seguinte.
O hélio é o único gás nobre que não tem 8 elétrons em sua
camada de valência.
A respeito da tabela periódica e dos modelos atômicos, julgue o item seguinte.
Na tabela periódica moderna, não é utilizada a classificação
semimetais.
A respeito da tabela periódica e dos modelos atômicos, julgue o item seguinte.
A eletronegatividade é a quantidade de energia envolvida no
processo em que o átomo isolado em seu estado fundamental
recebe um elétron.
A respeito da tabela periódica e dos modelos atômicos, julgue o item seguinte.
O modelo atômico de Bohr permitiu a Mendeleev
estabelecer a tabela periódica.
Para a eliminação completa de 12 mg de metanfetamina do corpo, são necessárias mais de 6 × 1020 moléculas de gás oxigênio.
Partindo das informações anteriores e considerando que MCO2 = 44,00 g/mol e MC10H15N = 149,00 g/mol sejam, respectivamente, as massas molares do CO2 e do C10H15N, e que a constante de Avogadro (NA) valha 6 × 1023 mol−1, julgue o item subsequente.
Para a eliminação completa de 16 mg de metanfetamina do
corpo, serão formados mais de 40 mg de gás carbônico,
considerando-se um rendimento de 80% desse processo.
Não procede a concepção reducionista da alquimia como práticas da Idade Média e do Renascimento que buscavam a transformação de metais menos nobres em ouro. Da mesma forma, não se pode simplificar dizendo-se que a transição da alquimia à química corresponde à ascensão da primeira em ciência. A alquimia, segundo algumas concepções, não pode ser considerada a origem da química, pois se restringia muito a concepções filosóficas da vida.
Internet:<http://www.qnesc.sbq.org.br/> (com adaptações).
Considerando o assunto do texto precedente, julgue o item que se segue.
A transformação de metais citada no texto assemelha-se
à atual transmutação dos elementos, como, por exemplo,
aquela que ocorre na síntese dos elementos com número
atômico maior que o do urânio na tabela periódica.