Questões de Concurso
Sobre transformações químicas: elementos químicos, tabela periódica e reações químicas em química
Foram encontradas 1.107 questões
I. Quando o sulfeto de chumbo e o óxido de chumbo são aquecidos juntos, os produtos são chumbo metálico e dióxido de enxofre. Se 14 g de óxido de chumbo reagem, forma-se 9,42 x 10-2 mol de átomos de chumbo. II. O mais importante processo comercial para converter N2 do ar em compostos contendo nitrogênio é baseado na reação de N2 e H2 para formar NH3. São formadas 4 mols de NH3 a partir de 3 mols de N2 e 6 mols de H2. III. Xileno é uma substância composta somente de carbono e hidrogênio. Uma amostra de xileno foi queimada em excesso de oxigênio e este produziu somente como produtos 33,4 g de CO2 e 8,55 g de água. A fórmula empírica do xileno é C4H5.
Está correto o que se afirma em
I. Os elementos em um grupo da tabela têm propriedades similares porque apresentam o mesmo tipo de organização dos elétrons na periferia dos átomos. II. Todos os metais, com exceção do mercúrio, são sólidos à temperatura ambiente. III. Enxofre, fósforo, selênio e telúrio são elementos não-metálicos.
Está correto o que se afirma em
Fe2O3(s) + 3CO(g) → 2 Fe(s) + 3CO2(g)
Com 75 g de Fe2O3 como reagente limitante, qual é o rendimento percentual se o rendimento real de Fe no teste foi 36,7 g?
I. As afinidades eletrônicas dos gases nobres são todas positivas, porque o elétron adicionado ocuparia um novo subnível de energia mais alta.
II. A diminuição na energia de ionização do Berílio ao Boro ocorre porque os elétrons no orbital preenchido 2s são mais eficientes em blindar os elétrons no subnível 2p do que são em se blindarem.
III. Em uma série isoeletrônica, o tamanho dos átomos aumenta com o aumento da carga nuclear à medida que os elétrons são atraídos mais fortemente pelo núcleo.
Está correto o que se afirma em
25 mL de HCl aproximadamente 0,1 mol/L com NaOH padronizado como 0,1000 mol/L
25 mL de CH3COOH aproximadamente 0,1 mol/L com NaOH padronizado como 0,1000 mol/L
São feitas as seguintes afirmações sobre as titulações:
I - O pH no ponto de equivalência é 7 em ambas as titulações.
II - O pH no ponto de equivalência é neutro na titulação HCl/NaOH e básico na titulação CH3COOH/NaOH.
III - O pH no ponto final é básico em ambas as titulações.
IV - O volume gasto em ambas será de aproximadamente 25 mL de NaOH.
Quais estão corretas?
I - H2O apresenta maior temperatura de ebulição do que H2S, pois apresenta ligações de hidrogênio.
II - SiCl4 tem maior momento de dipolo que SCl2, pois apresenta maior número de ligações polares C-Cl.
III - H2O e H2S apresentam temperaturas de ebulição semelhantes, pois apresentam ligações de hidrogênio. Além disso, apresentam momentos de dipolo semelhantes, pois apresentam estrutura angular.
Quais estão corretas?
(1) Ácido de Lewis ( ) NH3
(2) Base de Arrhenius ( ) CH3COOH
(3) Base fraca de Bronsted-Lowry ( ) KNO3
(4) Ácido forte de Bronsted-Lowry ( ) HCl
(5) Componente ácido de tampão ( ) NH4Cl
(6) Componente salino de tampão ácido ( ) BF3
(7) Sal ácido ( ) CH3COONa
(8) Sal neutro ( ) KOH
A sequência numérica correta de preenchimento dos parênteses da coluna da direita, de cima para baixo, é
H2S LiOH CuBr2 NaNO3 KF SO3 Na2O
Pode-se afirmar que as soluções apresentam, da esquerda para a direita, valores de pH a 25 ºC, conforme listados a seguir:
Para a obtenção de óxido de ferro (II), foi realizado um experimento em triplicata, envolvendo a queima de limalha de ferro. As massas, em gramas, de ferro e oxigênio usadas e os resultados do experimento estão relacionados no quadro a seguir.
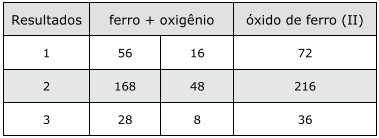
Com relação aos resultados obtidos, analise as afirmativas a seguir.
I - A razão das massas encontrada entre o ferro e o oxigênio é de 7/2.
II - No óxido de Fe(II), a proporção entre as massas de ferro e oxigênio será sempre constante.
III - A composição percentual de FeO será 70% de ferro e 30% de oxigênio.
Está(ão) correta(s)
Um laboratório recebeu uma amostra de calcário para que fosse analisado o seu grau de pureza. Pela decomposição de 240 g de calcário, foram produzidos 107 g
CaCO3 (s) → CaO (s) + CO2 (g)
A pureza encontrada, em percentagem, teve seu
valor mais próximo de
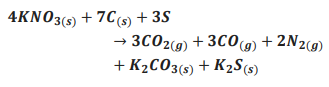
A expansão dos gases gerados nessa reação causa o efeito explosivo da pólvora. Considere uma munição com 10,10 g de pólvora reagindo de acordo com a equação acima, porém com somente 60% do salitre presente sofrendo essa reação. Assinale a alternativa que apresenta a quantidade de mols de gases gerados no disparo dessa munição?
MM (K=39 g/mol; N=14 g/mol; O=16 g/mol; C=12 g/mol; S=32 g/mol)
No que se refere a noções de tabela periódica, ligação química e estrutura molecular, julgue o item seguinte.
Os elementos da coluna 4A da tabela periódica possuem
quatro elétrons na última camada e, por isso, não apresentam
tendência para perder ou ganhar elétrons e sim para
compartilhar seus elétrons com outros átomos.
C2H6O + O2 → CO2 + H2O
Para a reação descrita, 3,0 g de C2H6O foi adicionado a um ambiente contendo 100,0 g de oxigênio. A massa (g) de CO2 produzida será, aproximadamente, de:
Dados de massas molares: C = 12 g/mol, H = 1 g/mol e O = 16 g/mol.
A aula experimental em laboratório de química configura uma atividade cujo objetivo é exercitar a observação e evidenciar a transformação química, seja pela mudança de coloração, formação de precipitados ou liberação de gases.
O trecho foi extraído de uma apostila de aulas experimentais de química. Nesse experimento, o aluno deverá perceber a formação de um precipitado amarelo.
Com o desenvolvimento dessa atividade, o aluno poderá perceber e concluir sobre a possível ocorrência de uma reação
I. Os elementos metálicos estão distribuídos na parte superior direita da tabela periódica. II. Os elementos metálicos estão distribuídos na parte inferior esquerda da tabela periódica. III. Elementos metálicos compartilham algumas similaridades em suas propriedades: são maleáveis, dúcteis e conduzem eletricidade. IV. Dentre os elementos não-metálicos, estão os essenciais à química dos seres vivos.
Estão corretas as asserções:
