Questões de Concurso
Comentadas sobre transformações químicas em química
Foram encontradas 1.723 questões
( ) Em 1913, Bohr propôs um modelo no qual os elétrons orbitam o núcleo, porém com uma órbita definida e particular. Bohr conhecia os trabalhos de Planck e Einstein. Em seu modelo, os elétrons ocupam estados estacionários de energia fixa. Os elétrons podem realizar saltos quânticos de um estado de energia para outro em que é liberado um fóton.
( ) O físico inglês J. J. Thomson usou o tubo de raios catódicos e seu conhecimento da teoria eletromagnética para determinar a razão entre a carga elétrica e a massa de um elétron.
( ) O modelo atômico de Dalton propôs que a matéria é constituída de minúsculas partículas, como uma minúscula esfera maciça, impenetrável, indestrutível, indivisível e sem carga.
( ) Thomson propôs que um átomo podia ser imaginado como uma esfera com carga positiva uniforme de matéria, na qual os elétrons estão embutidos como passas em um bolo. Esse modelo chamado de “pudim de passas” foi a teoria aceita durante muitos anos.
A ordem correta de preenchimento dos parênteses, de cima para baixo, é:
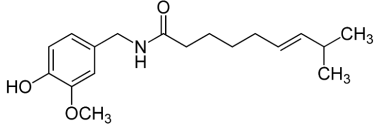
I. Apresenta as funções cetona e amina em sua estrutura.
II. Possui oito átomos de carbono com hibridização sp2 .
III. Apresenta dois carbonos terciários, oito carbonos secundários e dois carbonos primários.
IV. Possui três átomos de carbono com hibridização sp.
V. Apresenta fórmula molecular C18H27NO3.
Quais estão corretas?
Em relação aos conceitos de mol, massa molar e concentração de soluções, julgue o item.
Conceitualmente, é correto afirmar que uma entidade elementar equivale a 6,022×1023 mols.
Para cada mol de ácido fosfórico, são necessários três mols de hidróxido de sódio para produzir um mol de fosfato de sódio (Na₃PO₄) e três mols de água.
O hidrogênio tem capacidade de reagir com metais ativos para formar hidretos metálicos sólidos, como, por exemplo: 2Na(s) + H2(g) → 2NaH(s).
Ao misturar AgNO3 e NaCl em solução aquosa, formará um sal insolúvel (NaNO3) e um sal solúvel (AgCl).
(1) Combustão. (2) Decomposição.
( ) 2H2O2 → 2H2O + O2 ( ) 2KBrO3 → 2KBr + 3O2 ( ) CH4 +2O2 → 2H2O + CO2
O(A) ___________ de um elétron é conhecido(a) como __________, e o átomo ou a molécula que perde o elétron se diz __________. O(A) __________ é ao contrário, o(a) ____________ de um elétron tornando o átomo ou molécula _________. As reações de oxidação e redução sempre ocorrem simultaneamente.
Pode-se obter o bórax anidro (Na2B4O7) através da reação representada pela equação não balanceada:
Ácido bórico + Metaborato de sódio → Na2B4O7 + H2O
A alternativa que apresenta as fórmulas corretas dos reagentes utilizados para sintetizar o bórax é:

A reação química entre sulfato ferroso e permanganato de potássio em meio ácido é representada pela seguinte reação química:
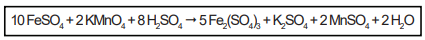
Nessa reação, o elemento químico que sofre oxidação tem como símbolo:
A fórmula química desse composto corresponde a:
NaHCO3(s) + H3 O+ (aq) → Na+ (aq) + 2H2 O(l) + CO2(g)
Considerando-se a proporção estequiométrica e o rendimento completo de reação, a massa de bicarbonato de sódio necessária para neutralizar 20,0 L de solução aquosa, cujo pH medido foi 2, é