Questões de Concurso
Comentadas sobre transformações químicas em química
Foram encontradas 1.723 questões

I A pressão parcial do CO (g), a qualquer momento, será igual à pressão parcial do CH4 (g).
II A pressão total, a qualquer momento, corresponde à média entre as pressões parciais de cada gás presente no sistema.
III A pressão parcial do H2 (g) será sempre superior à do CO (g).
Assinale a opção correta.
( ) Para elementos do grupo principal, movendo-se de um elemento para outro ao longo de um período, o raio atômico diminui devido ao aumento da carga nuclear efetiva (Z*).
( ) A energia de ionização (EI) é a energia necessária para adicionar um elétron de um átomo no estado gasoso e fundamental.
( ) A entalpia de adição eletrônica (ΔAEH) para muitos elementos é positiva, indicando que esse processo é endotérmico e que a energia é absorvida.
( ) Considerando o tamanho do raio iônico, quando comparado com o raio atômico do átomo (no estado fundamental), os cátions terão raios menores que o átomo no estado fundamental e os ânions terão raios maiores que os átomos no estado fundamental.
Assinale a sequência correta.
Dados: H=1, C=12, O=16; R= 0,082 L.atm/mol.K T(K)= T(°C) + 273
O 60Co é isótono do nuclídeo
Dado: Número atômico do Mn = 25 Número atômico do Fe = 26 Número atômico do Co = 27 Número atômico do Ni = 28 Número atômico do Cu = 29
Considerando-se comportamento ideal, qual será a pressão, em kPa, quando o cilindro de gás for resfriado a 8º C?
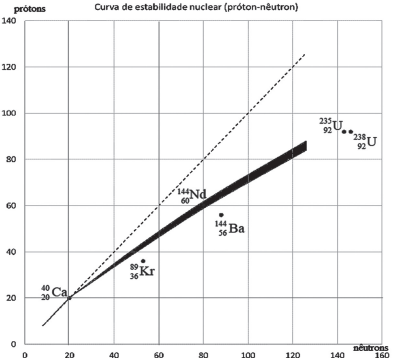
Considerando-se a Figura, verifica-se que o(a)
Um fóton de radiação apresenta comprimento de onda de 8,0 x 10-7 m. A energia, em joules, desse fóton é aproximadamente igual a


No estado fundamental, a distribuição eletrônica dos átomos de enxofre corresponde a
1s2 2s2 2p6 3s2 3p4
Sabendo que ZPt = 78, julgue o item que se segue, acerca do complexo [Pt(NH3)2Cl2], cujas estruturas possíveis são mostradas nas figuras 1 e 2.
A configuração eletrônica do íon metálico do complexo em
apreço termina em um orbital d8
.
Julgue o item seguinte, relativos às propriedades periódicas.
A energia de ionização é aquela liberada quando um átomo
isolado no estado fundamental, em fase gasosa, recebe um
elétron.
Julgue o item seguinte, relativos às propriedades periódicas.
Na tabela periódica, os raios atômicos aumentam de cima
para baixo no sentido vertical das famílias e diminuem da
esquerda para a direita no sentido horizontal dos períodos.
Julgue o item seguinte, relativos às propriedades periódicas.
Via de regra, quanto maiores forem os raios atômicos, mais
elevadas serão as energias de ionização.
Acerca de gases, julgue o item seguinte, considerando que o volume molar valha 22,4 L, que a constante universal dos gases perfeitos valha 62,4 L · mmHg · K−1 · mol−1 e que MH = 1 g/mol e MO = 16 g/mol.
A equação de Clapeyron pode ser utilizada para gases reais,
desde que seja inserido fator de compressibilidade.
Acerca de gases, julgue o item seguinte, considerando que o volume molar valha 22,4 L, que a constante universal dos gases perfeitos valha 62,4 L · mmHg · K−1 · mol−1 e que MH = 1 g/mol e MO = 16 g/mol.
Um gás cuja densidade seja de 1,26 g/L à temperatura de
50 ℃ e à pressão de 747 mmHg tem massa molar inferior a
35 g/mol.
Acerca de gases, julgue o item seguinte, considerando que o volume molar valha 22,4 L, que a constante universal dos gases perfeitos valha 62,4 L · mmHg · K−1 · mol−1 e que MH = 1 g/mol e MO = 16 g/mol.
Nas condições normais de temperatura e pressão (CNTP),
180 g de água no estado de vapor ocupam um volume de
224 L.
Acerca de gases, julgue o item seguinte, considerando que o volume molar valha 22,4 L, que a constante universal dos gases perfeitos valha 62,4 L · mmHg · K−1 · mol−1 e que MH = 1 g/mol e MO = 16 g/mol.
A relação entre pressão e volume é norteada pela lei de
Avogadro.
