Questões de Concurso
Comentadas sobre transformações químicas em química
Foram encontradas 515 questões
Acerca da natureza elétrica da matéria, julgue o próximo item.
Conforme o modelo atômico de Dalton, também conhecido
como modelo pudim de passas, o átomo é tal qual uma esfera
de material gelatinoso com carga positiva sobre a qual os
elétrons ficam suspensos.
Se uma peça de aço carbono que contém 5 g de ferro for completamente oxidada pelo H2S, serão formados mais de 8 g de mackinawita.
Considerando o texto apresentado, avalie as proposições a seguir:
I- Modelo bola de bilhar: Dalton teve a ideia de que deveria ser algo maciço muito pequeno e indivisível, chamado de átomo.
II- Modelo pudim de passas: Thompson identificou partículas negativas, denominadas de elétrons, e supôs que também deveria haver prótons.
III- Modelo Rutherford-Bohr: Rutherford determinou que o átomo é formado por duas regiões (o núcleo e a eletrosfera) e Bohr inferiu que havia neutros permitindo que houvesse um espaço entre as camadas de elétrons dos átomos.
É CORRETO o que se afirma em:
Com base nessas informações, julgue o próximo item.
A etapa II do mecanismo proposto, em que a molécula de
ozônio reage com o oxigênio atômico, é bimolecular.
A respeito da tabela periódica e dos modelos atômicos, julgue o item seguinte.
O modelo atômico de Bohr permitiu a Mendeleev
estabelecer a tabela periódica.
Para a eliminação completa de 12 mg de metanfetamina do corpo, são necessárias mais de 6 × 1020 moléculas de gás oxigênio.
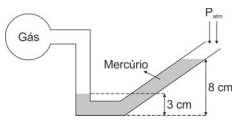
Sabendo que a pressão atmosférica local é de 76 cmHg, a pressão do gás é
25 mL de HCl aproximadamente 0,1 mol/L com NaOH padronizado como 0,1000 mol/L
25 mL de CH3COOH aproximadamente 0,1 mol/L com NaOH padronizado como 0,1000 mol/L
São feitas as seguintes afirmações sobre as titulações:
I - O pH no ponto de equivalência é 7 em ambas as titulações.
II - O pH no ponto de equivalência é neutro na titulação HCl/NaOH e básico na titulação CH3COOH/NaOH.
III - O pH no ponto final é básico em ambas as titulações.
IV - O volume gasto em ambas será de aproximadamente 25 mL de NaOH.
Quais estão corretas?
(1) Ácido de Lewis ( ) NH3
(2) Base de Arrhenius ( ) CH3COOH
(3) Base fraca de Bronsted-Lowry ( ) KNO3
(4) Ácido forte de Bronsted-Lowry ( ) HCl
(5) Componente ácido de tampão ( ) NH4Cl
(6) Componente salino de tampão ácido ( ) BF3
(7) Sal ácido ( ) CH3COONa
(8) Sal neutro ( ) KOH
A sequência numérica correta de preenchimento dos parênteses da coluna da direita, de cima para baixo, é
H2S LiOH CuBr2 NaNO3 KF SO3 Na2O
Pode-se afirmar que as soluções apresentam, da esquerda para a direita, valores de pH a 25 ºC, conforme listados a seguir:
I - A temperatura de equilíbrio será 50 ºC.
II - A água fria sofre aumento de energia interna e de entropia.
III - A água fria sofre aumento de entalpia e diminuição de entropia.
IV - A água quente sofre diminuição de energia interna e aumento de entropia.
Quais estão corretas?
I - Fórmula química do solvente e concentração da solução de limpeza.
II - Concentração comum da solução e concentração molar do soluto.
III - Peso dos metais pesados na solução final e concentração da solução salina.
Quais correspondem aos principais cálculos que devem ser utilizados no preparo de soluções?
Para a obtenção de óxido de ferro (II), foi realizado um experimento em triplicata, envolvendo a queima de limalha de ferro. As massas, em gramas, de ferro e oxigênio usadas e os resultados do experimento estão relacionados no quadro a seguir.
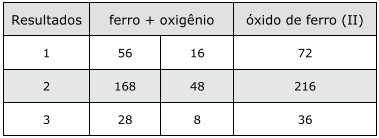
Com relação aos resultados obtidos, analise as afirmativas a seguir.
I - A razão das massas encontrada entre o ferro e o oxigênio é de 7/2.
II - No óxido de Fe(II), a proporção entre as massas de ferro e oxigênio será sempre constante.
III - A composição percentual de FeO será 70% de ferro e 30% de oxigênio.
Está(ão) correta(s)
