Questões de Concurso
Sobre transformações químicas em química
Foram encontradas 1.981 questões
FeCl 3(aq) + NH4 OH(aq) → Fe(OH) 3(s) + NH4 Cl (aq)
Nessa transformação química, e de acordo com os símbolos e códigos da reação, observa-se que
Na reação de combustão do metano, qual é a quantidade de O2 (g), em mols, necessária para que 6 mols de CH4 (g) sejam completamente consumidos na reação, produzindo CO2 (g) e H2 O?
Reação 1:
2 Mg(s) + O2 (g) 2MgO(s): reação que acontece em flashes descartáveis de fotografia.
Reação 2:
2NaN3 (s) 3N2 (g) + 2Na(s): reação advinda do acionamento de dispositivos de segurança presentes nos automóveis, chamados airbags. A decomposição do NaN3 (s) origina N2 (g), que os faz inflar.
Reação 3:
Zn(s) + 2HC(aq) ZnC
 2 (aq) + H2 (g): reação que ocorre quando uma lâmina de zinco é colocada em uma solução aquosa de ácido clorídrico, havendo a formação do ZnC
2 (aq) + H2 (g): reação que ocorre quando uma lâmina de zinco é colocada em uma solução aquosa de ácido clorídrico, havendo a formação do ZnC 2 (aq) e gás hidrogênio.
2 (aq) e gás hidrogênio.Reação 4:
BaC
 2 (aq) + Na2 SO4 (aq) BaSO4 (s) + 2 NaC(aq): a reação de cloreto de bário com sulfato de sódio produz o cloreto de sódio e o sulfato de bário precipitado.
2 (aq) + Na2 SO4 (aq) BaSO4 (s) + 2 NaC(aq): a reação de cloreto de bário com sulfato de sódio produz o cloreto de sódio e o sulfato de bário precipitado. Após analisar essas reações, uma estudante de Química fez as seguintes afirmações:
I – As reações 1 e 3 são de “síntese”, e a reação 2 é de “decomposição”.
II – As reações 3 e 4 são, respectivamente, de “simples troca” e de “dupla troca”.
III – A reação 2 é de decomposição.
IV – A reação 1 é de síntese.
Com base na teoria das classificações das reações químicas, a estudante fez afirmações corretas APENAS em
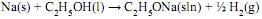
Para eliminar um resíduo de 230 mg de sódio, a massa necessária de etanol é, em miligramas, igual a
 são menos densos do que o ar. Comparando as densidades desses dois gases, em idênticas condições de pressão e temperatura, pode-se afirmar que a do hélio, em relação à do hidrogênio, é
são menos densos do que o ar. Comparando as densidades desses dois gases, em idênticas condições de pressão e temperatura, pode-se afirmar que a do hélio, em relação à do hidrogênio, é I - N2 e O2 não podem ser comprimidos até a liquefação.
II - N2 e O2 não são ?uidos, por serem gases razoavelmente inertes.
III - A densidade do ar é maior que a do nitrogênio nas condições normais de temperatura e pressão.
Dados
MO = 16 g mol -1
MN = 14 g mol -1 )
Está correto APENAS o que se afirma em
Dados
MO = 16 g mol -1
MN = 14 g mol -1
MH = 1 g mol -1
5H2 C2 O4 + 2KMnO4 + 6H+
→
10 CO2 + 2Mn2+ + 8H2 OO volume, em mL, de solução de KMnO4 0,165 mol/L, necessário para reagir com 108 mL de ácido oxálico, de igual concentração molar, é

A partir das informações contidas no fragmento de texto acima, julgue os itens que se seguem.
Considerando-se uma massa fixa de gás com volume constante, é correto afirmar que o aumento da temperatura aumenta a velocidade média das moléculas e, consequentemente, o número de colisões.

A partir das informações contidas no fragmento de texto acima, julgue os itens que se seguem.
Sabendo-se que, em um cilindro, haja 7,66 kg de gás oxigênio a uma pressão de 300 bar a 25 °C e considerando-se que R = 0,082 atm.L/mol. K, M (O) = 16 g/mol, 0 °C = 273 K e 1 bar = 0,987 atm, é correto afirmar que o volume desse cilindro é de 30 litros.

A partir das informações contidas no fragmento de texto acima, julgue os itens que se seguem.
A transformação isotérmica é definida pela Lei de Boyle, segundo a qual o volume e pressão são inversamente proporcionais, mesmo quando ocorre variação na quantidade de matéria.

A partir das informações contidas no fragmento de texto acima, julgue os itens que se seguem.
Sabendo-se que a densidade dos gases pode ser definida pela sua massa molar e considerando-se que M(C) = 12 g/mol, M (O) = 16 g/mol, M (H) = 1 g/mol, M (Ar) = 40 g/mol e M(N) = 14 g/mol e que a composição do ar em volume seja de 78% de N2, 21% de O2 e 1% de Ar, é correto afirmar que os gases CO2, NH3 e CH4 são mais densos que o ar atmosférico

A partir das informações contidas no fragmento de texto acima, julgue os itens que se seguem.
Considerando-se que o ar atmosférico que respiramos seja composto por CO2, O2, N2 e H2O, com 20,9% de O2, e que, no nível do mar, a pressão atmosférica seja de 760 mmHg, é correto afirmar que a pressão parcial exercida pelo O2 é de 0,209 atm.
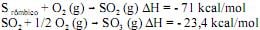
Considerando essas equações químicas, julgue os itens seguintes.
A reação global pode ser representada pela seguinte equação:
S rômbico + 3/2 O2 (g) → SO3 (g) ΔH = -94,4 kcal/mol.
O carbono constitui toda matéria orgânica, havendo, nos seres vivos, uma razão entre a quantidade de carbono-14 — isótopo radioativo — e de carbono-12, de modo que, quando o organismo morre, a relação entre carbono-14 e carbono-12 decresce.