Questões de Concurso
Sobre transformações químicas em química
Foram encontradas 2.096 questões
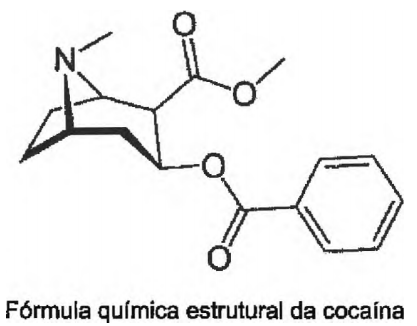
Observe a figura e a tabela abaixo:
Cocaína
|
Forma de apresentação |
Fórmula molecular |
Massa molar (g/mol) |
Ponto de fusão (°C) |
pK |
|
Cocaína (base livre) |
C17H21NO4 |
303,4 |
96-98 |
pKa = 5,4 |
|
Cocaína .HCI |
C17H21NO4.HCI |
339,8 |
195-197 |
pKa = 8,6 |
Tabela: Propriedades físico-químicas da cocaína.
A respeito da cocaína, é INCORRETO afirmar que:
I- 2s¹
II- 3s², 3p⁵
III- 4s²
IV- 2s², 2p⁴
I. O elemento Césio (Cs) é mais eletropositivo que o elemento Bário (Ba).
II. O elemento Césio (Cs) tem maior raio atômico que o elemento Potássio (K).
III. O elemento Flúor (F) é mais eletronegativo que o elemento Iodo (I).
IV. O íon Ba⁺² possui raio atômico maior comparado ao do íon Ba⁺¹.
Quais estão corretas?
Um Perito Criminal Especial, ao realizar análise química qualitativa preliminar para identificação de cocaína, efetua as reações químicas descritas abaixo. Identifique a resposta que correlaciona corretamente a reação química com o princípio da técnica empregado.
Por meio do efeito Joule-Thomson, descreve-se a variação de temperatura de um gás, mantido isolado e em condições adiabáticas, ao ser forçado a passar através de uma válvula. Dependendo da temperatura e da natureza do gás, esse efeito pode resultar em aquecimento ou resfriamento, o que pode ser previsto mediante os valores do coeficiente de Joule-Thomson (μJT) e da temperatura de inversão do gás. O gráfico a seguir esboça a dependência de μJT com a temperatura para o gás hidrogênio.
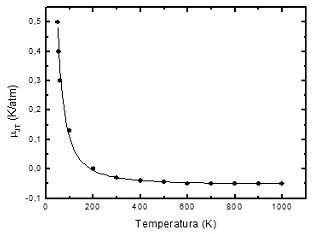
Nesse sentido, é correto afirmar que o hidrogênio, ao passar pela
válvula de uma câmara à alta pressão para outra câmara à pressão
atmosférica a 25 °C, sofrerá
Em 1930, o neutrino foi proposto, pelo físico alemão Wolfgang Pauli, como uma tentativa teórica para explicar os fenômenos observados no decaimento beta, que, como se sabe atualmente, consiste na desintegração do nêutron no núcleo atômico. A confirmação experimental da proposta ocorreu em 1956, pelos físicos americanos Clyde Cowan e Frederico Reines, que, pelo feito, foram laureados com o prêmio Nobel de 1995.
J. L. Ferreira e A. E. Santana. Física na Escola. n.º 7, 2006, p. 41 (com adaptações).
Com base no texto, é correto afirmar que a evidência experimental da existência do neutrino reforça a concepção
De acordo com a teoria dos orbitais moleculares, a distribuição eletrônica do óxido nítrico é [(σ1s)2 (σ*1s)2 (σ2s)2 (σ*2s)2 (σ2p)2 (π2p)4 (π*2p)1 ]. Com base nessa informação, assinale a opção que corresponde ao número de elétrons em orbitais antiligantes presentes em uma molécula de óxido nítrico ionizada, de acordo com o processo a seguir:
NO(g) → NO+ (g) + e-
O nitreto de silício (Si3N4), que é um composto cerâmico que combina diferentes propriedades, como alta resistência mecânica, moderada condutividade térmica e baixo coeficiente de dilatação térmica, tem sido empregado na fabricação de turbinas a gás, peças de motores automotivos e rolamentos e ferramentas de corte de metais. Industrialmente, o composto pode ser preparado por redução carbotérmica em atmosfera de nitrogênio, de acordo com a equação química a seguir.
3SiO2(s) + 6C(s) + 2N2(g) → Si3N4(s) + 6CO(g)
Com base nesse processo, a máxima massa em Kg de nitreto de
silício formada, em quilogramas, quando são colocados para reagir
360,0 kg de SiO2(s), 160,0 kg de C(s) e 140,0 kg de N2(g)
corresponde a
Após uma reação química de queima, foram coletados, da câmara de combustão, os gases butano, oxigênio, dióxido de carbono, monóxido de carbono e água. Os gases foram acondicionados, sob temperatura e pressão constantes, em recipientes separados e deformáveis, cujos volumes aferidos estão especificados no quadro a seguir.
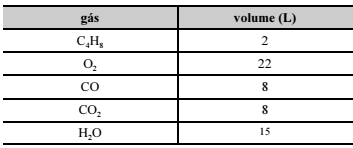
De acordo com a hipótese de Avogadro, é correto afirmar que o
número total de átomos é igual nos recipientes que contêm
Em um experimento para sintetizar o gás cloreto de hidrogênio, sob pressão e temperatura constantes, foram misturados diferentes volumes dos gases hidrogênio e cloro. Os resultados obtidos estão listados no quadro a seguir.
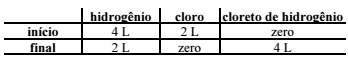
Com base nessas informações, é correto afirmar que a equação
química balanceada de preparação do cloreto de hidrogênio
corresponde a

A introdução de átomo de halogênio no anel aromático do esqueleto básico de substâncias ilícitas se tornou uma importante ferramenta
para a obtenção de novas drogas sintéticas, o que deixou o mercado ilegal dessas substâncias um passo a frente da legislação que controla
o tráfico de drogas. Considerando essas informações e as figuras I e II, acima, que representam, respectivamente, estruturas químicas de
algumas drogas sintéticas comuns e as dessas mesmas drogas, na forma halogenada, julgue item que segue.
Basicamente, existem dois tipos de pólvora: a pólvora negra e a pólvora sem fumo. Quase todas as armas de fogo modernas usam a pólvora sem fumo. A pólvora negra, classificada como explosivo, é composta por enxofre, carvão e nitrato de potássio. Entre as várias reações que ocorrem na explosão da pólvora negra, a mais simples está descrita pela seguinte equação química:
2KNO3(s) + S(s) + 3C(s) 6 K2S(s) + N2(g) + 3CO2(g).
Com base nessas informações, julgue o item.
A redução do nitrato, que consome três moles de elétrons por
mol de NO3
–
em meio ácido, gera o óxido nítrico, que é um
agente complexante mais forte que o íon nitrato.
Basicamente, existem dois tipos de pólvora: a pólvora negra e a pólvora sem fumo. Quase todas as armas de fogo modernas usam a pólvora sem fumo. A pólvora negra, classificada como explosivo, é composta por enxofre, carvão e nitrato de potássio. Entre as várias reações que ocorrem na explosão da pólvora negra, a mais simples está descrita pela seguinte equação química:
2KNO3(s) + S(s) + 3C(s) 6 K2S(s) + N2(g) + 3CO2(g).
Com base nessas informações, julgue o item.
Se o gás carbônico reagir com a água para formar o ácido
carbônico, o CO2 receberá um par de elétrons da água, que é
uma base de Lewis.