Questões de Concurso
Sobre transformações químicas em química
Foram encontradas 1.983 questões
O complexo [M(NH3)6] +3 contém um total de 126 elétrons.
Indique a opção que aponta o número atômico de M e a geometria espacial do composto de coordenação em questão.
Considerando que a parafina é o principal componente de velas (cada vela contém aproximadamente 1,60 g de parafina), que tem fórmula C22H46 e massa molecular de 310 g mol -1, e que o aumento do volume do gás volume molar dos gases nas CNTP: 24 L mol-1 se deu apenas pela queima completa desse material, nesse caso hipotético, que quantidade de velas resultou na morte do referido homem?
A reação de 10,6 kg de carbonato de sódio com quantidade suficiente de ácido clorídrico, pela equação
Na2CO3(s) + HCl(aq) → NaCl (s) + CO2 (g) + H2O(l),produz menos de 10 kg de NaCl.
A decomposição térmica total de 300 g de carbonato de cálcio produz 168 g de óxido de cálcio e 67,2 L de CO2 nas condições normais de temperatura e pressão, considerando-se o volume molar de CO2 de 22,4 L.
O nitroprussiato de sódio — Na2[Fe(CN)5NO] — é um composto empregado como fonte de óxido nítrico — um potente vasodilatador — administrado por via intravenosa em pacientes em situação de emergência hipertensiva. O uso inadequado desse medicamento, que é sensível à luz e que produz cianeto em sua decomposição, pode causar morte acidental por déficit de oxigênio no organismo.
Com base nas informações apresentadas, julgue o próximo item.
Caso todos os ligantes desse composto fossem substituídos por
íons Br–
, o ânion gerado seria o hexabromoferrato(III), que
absorve radiação em comprimento de onda maior que o
absorvido pelo Na2[Fe(CN)5NO].
13Al2+ 11Na 10Ne+
Pode-se dizer que elas são:
Um composto é formado de 92,32% de carbono e 7,68% de hidrogênio. Nas condições normais de temperatura e pressão (CNTP), 11,2 L de seu vapor pesam 39 g. A sua fórmula molecular é:
Dados: C=12 e H=1.
I:2NiS+3O2 → 2NiO+2SO2
II:NiO+C→ Ni+CO
Duas toneladas de um minério contendo NiS foram processadas,obtendo-se 293,5gramasdeNíquel metálico. O percentualaproximadodeNiSnominérioprocessadofoide:
Considerando esse caso hipotético e que a massa molar do H2 é 2,00 g.mol-1 e o valor da constante universal dos gases é 0,082 J.mol-1 .K-1 , os valores do calor de combustão, ΔU, por massa e por mol são, respectivamente:
Considerando esse caso hipotético e que a massa molar do H2 é 2,00 g.mol -1 e o valor da constante universal dos gases é 0,082 J.mol -1 .K-1 , os valores do calor de combustão, ΔU, por massa e por mol são, respectivamente:
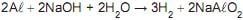
A quantidade de gás hidrogênio, em mol, obtido, nesse experimento, é, aproximadamente,
Considerando o texto acima e que as massas molares de H, C, O e Cl sejam, respectivamente, 1,0 g/mol, 12,0 g/mol, 16,0 g/mol, 35,5 g/mol, julgue os itens que se seguem.
No texto, são citados três sais de metais alcalinos.
 H0c), definido como a energia liberada na queima completa de um mol de combustível no estado padrão. A Tabela 68 apresenta a relação entre alguns combustíveis.
H0c), definido como a energia liberada na queima completa de um mol de combustível no estado padrão. A Tabela 68 apresenta a relação entre alguns combustíveis.
Neste contexto, indique qual dos combustíveis, quando queimado completamente, libera mais dióxido de carbono no ambiente pela mesma quantidade de energia produzida.
C2H5SH + H2 → C2H6 + H2S
O H2S é posteriormente convertido em H2SO4. O enxofreou o ácido sulfúrico produzidos na dessulfurização do petróleosão importantes matérias-primas para outras indústrias, como a deplásticos e a farmacêutica.
Tendo as informações acima como referência inicial, julgue os itens a seguir.
A combustão de um mol de um alceno ou de um cicloalcano produz uma quantidade de matéria de CO2 e de H2O equivalente, em mol, à quantidade de carbono presente na molécula do hidrocarboneto