Questões de Concurso
Sobre transformações químicas em química
Foram encontradas 1.983 questões
KHC8H4O4 + NaOH → NaKH(C8H4O4) + H2O
Assinale a alternativa que responde CORRETAMENTE à questão.
Texto para a questão.
A exploração, em sala de aula, do tema sabões e detergentes permite diferentes enfoques e técnicas de ensino, que promovem o pensamento crítico dos alunos por se tratar de um tema organizador relacionado a seu cotidiano. Tal proposta valoriza o aluno como indivíduo pensante, promovendo o papel do professor a mediador e orientador do processo educacional. Isso valoriza o papel desempenhado pela escola e contribui com o processo de aprendizagem da química, favorecendo, encorajando e sustentando a autoconstrução e o desenvolvimento do conhecimento por parte dos alunos. Nesse contexto, a equação genérica seguinte descreve o processo de saponificação, em que R corresponde a cadeias iguais ou diferentes, contendo entre 12 e 18 átomos de carbono.

Com base nesse caso hipotético, assinale a alternativa que apresenta o valor mais próximo da massa de NaOH necessária para essa reação.
6 H+ + 5 H2C2O4 + 2 MnO4- → 10 CO2 + 2 Mn2+ + 8 H2O
determine a porcentagem em massa de carbonato de cálcio na referida mistura de cloretos.
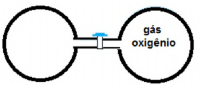
Na seguinte figura, o recipiente da esquerda tem volume V, pressão P, temperatura T e contém 84 gramas de uma gás ideal. O recipiente da direita, também de volume V, contém 96 g de gás oxigênio puro, também ideal, na pressão P e temperatura T. Com base nessas informações, o gás contido no recipiente da esquerda é o
Um recipiente de volume igual a 1 m3 contém gás hélio com pressão parcial de 15 atm. Uma quantidade desse gás foi transferida, sem perda significativa, para um outro recipiente, inicialmente vazio e de volume igual a 5 m3 , até que a pressão parcial do hélio atingisse, nesse último, a pressão de 2 atm. As medições de pressão foram feitas quando o gás estava na temperatura de 298 K, e as condições foram ideais.
A massa de gás hélio, em g, que foi transferida do recipiente de menor volume para o de maior volume foi mais próximo de
Dados
M (H2 ) = 2 g mol-1 .
R = 0,082 atm L mol-1 K-1
1 m3
= 1000 L
Após uma reação química de queima, foram coletados, da câmara de combustão, os gases butano, oxigênio, dióxido de carbono, monóxido de carbono e água. Os gases foram acondicionados, sob temperatura e pressão constantes, em recipientes separados e deformáveis, cujos volumes aferidos estão especificados no quadro a seguir.
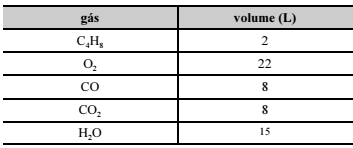
De acordo com a hipótese de Avogadro, é correto afirmar que o
número total de átomos é igual nos recipientes que contêm
A queima de gás metano ocorre conforme a equação abaixo:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(vapor)
Para a queima ao ar de 224 litros de metano, o volume total de ar utilizado na combustão e o volume total de gases e vapores ao final da combustão serão, respectivamente, de quantos litros?

O nitroprussiato de sódio — Na2[Fe(CN)5NO] — é um composto empregado como fonte de óxido nítrico — um potente vasodilatador — administrado por via intravenosa em pacientes em situação de emergência hipertensiva. O uso inadequado desse medicamento, que é sensível à luz e que produz cianeto em sua decomposição, pode causar morte acidental por déficit de oxigênio no organismo.
Com base nas informações apresentadas, julgue o próximo item.
Caso todos os ligantes desse composto fossem substituídos por
íons Br–
, o ânion gerado seria o hexabromoferrato(III), que
absorve radiação em comprimento de onda maior que o
absorvido pelo Na2[Fe(CN)5NO].
Uma transição eletrônica envolve a transferência de um elétron de um orbital para outro. Tanto os átomos (orbitais atômicos) como as moléculas (orbitais moleculares) podem sofrer esse tipo de transição. A diferença de energia entre os orbitais 3s e 3p para o átomo de sódio é de 2,107 eV. Indique qual o comprimento de onda da radiação que será absorvida ao se excitar um elétron de um orbital 3s para o orbital 3p.
Dados:
Constante de Planck (h)=6,63 x 10-34 J s
1eV = 1,60 x 10-19 J)
O cloreto de cobalto (II) é um composto químico utilizado como indicador de umidade devido às suas diferentes formas anidra e hidratada apresentarem coloração bem distinta. A forma anidra CoCl é azul, e a forma hidratada (úmida) CoCl2 ·6H2O é rosa profundo. Esta característica o faz ser um dos mais comuns compostos de cobalto em laboratórios. A forma anidra pode ser preparada a partir do metal cobalto e gás :
Co(s) + Cl2(g) → CoCl2(s)
Uma mistura em equilíbrio contém 20 g de CO, 35 g
de Cl2 e 198 g de COCl2 num recipiente de 2,5 L de
capacidade. Identifique a alternativa que apresenta,
respectivamente, as concentrações molares (mol/L)
do Co, Cl2 e do CoCl2 , de forma correta:
Sobre a classificação periódica dos elementos, a estrutura da classificação periódica, suas relações com a configuração eletrônica e as principais propriedades periódicas. Julgue as sentenças a seguir:
I. O elemento Boro (B, Z = 5, massa atômica = 11) é classificado como um metal alcalino.
II. Os elementos inseridos no grupo dos lantanídeos apresentam o elétron de diferenciação em um orbital .
III. O Iodo (I, Z = 53) apresenta raio atômico menor que o Cloro (Cl, Z =17).
IV. Os elementos Cálcio (Ca), Magnésio (Mg) e Rádio (Ra) são classificados como metais alcalinos terrosos.
V. A eletronegatividade diminui à medida que se aumenta o período da tabela periódica