Questões de Concurso
Sobre transformações químicas em química
Foram encontradas 1.983 questões
Acerca desse assunto, julgue os itens.
Com relação a esse assunto, julgue os itens.
Com relação a esse assunto, julgue os itens.
Com relação a esse assunto, julgue os itens.

A figura acima apresenta as curvas do coeficiente de compressibilidade (Z) em função da pressão para dois gases, A e B, ambos a 273 K. Com relação a essa figura, julgue os itens a seguir.

A figura acima apresenta as curvas do coeficiente de compressibilidade (Z) em função da pressão para dois gases, A e B, ambos a 273 K. Com relação a essa figura, julgue os itens a seguir.
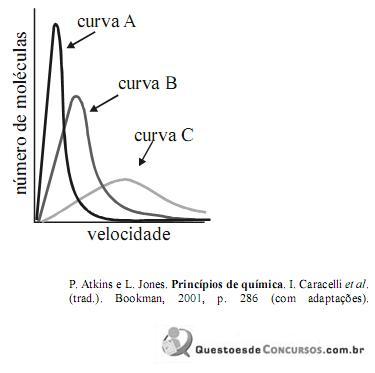
Com relação à figura acima, que apresenta as distribuições de velocidades de Maxwell para três diferentes gases a uma mesma temperatura, julgue o item seguinte.
A curva A corresponde ao gás com menor massa molar e a curva C, ao gás com maior massa molar.

Com base nessas informações, julgue os itens que se seguem.
Os complexos de metais de transição com configuração eletrônica d9 , tais como o complexo
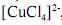 , caracterizam-se pela geometria quadrado planar.
, caracterizam-se pela geometria quadrado planar. 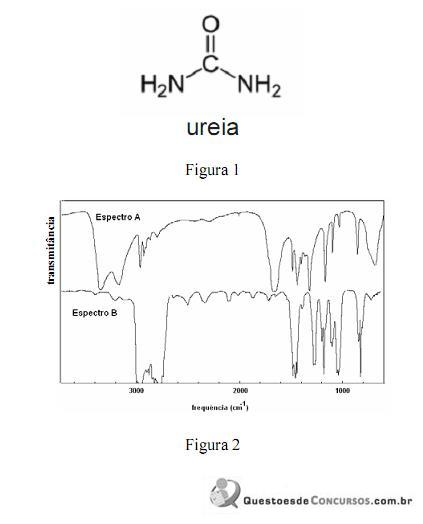
A amônia serve como substrato para a síntese de um grande número de substâncias, como aminas e amidas. Merece destaque a ureia, que é largamente empregada como fertilizante e cuja estrutura é apresentada na figura 1. Na figura 2, são apresentados os espectros de infravermelho de duas outras substâncias que podem ser sintetizadas a partir da amônia: a propanamida e a trietilamina, sendo que os espectros não estão apresentados, necessariamente, nessa ordem. Com relação aos derivados da amônia citados e aos espectros apresentados, julgue os itens que se seguem.
A reação da amônia com a propanona resulta na formação da etanamida.
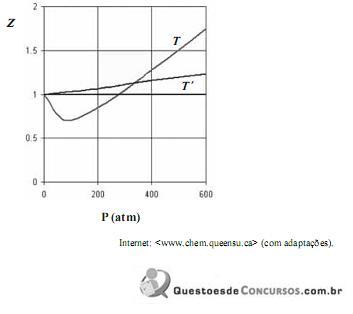
Considerando que, sob pressões elevadas, os gases deixam de apresentar comportamento ideal, e que a figura acima apresenta as curvas do coeficiente de compressibilidade (Z) para o
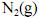 em duas temperaturas distintas (T e T’), julgue os itens subsequentes.
em duas temperaturas distintas (T e T’), julgue os itens subsequentes.À temperatura T’ e à pressão de 200 atm, o
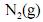 apresenta volume molar maior que o previsto pela lei dos gases ideais.
apresenta volume molar maior que o previsto pela lei dos gases ideais. 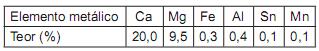
Um recurso empregado para controlar a emissão de poluentes consiste na adição de calcário ao leito fluidizado em que se queimam carvões contendo enxofre. Considerando-se o uso de um calcário dolomítico com a composição indicada acima, qual a quantidade estequiométrica, em kg, a ser utilizada por tonelada de carvão no caso de um combustível com 1,6% de enxofre (S)?
Dado: Leve em conta apenas o óxido de cálcio na eficiência do processo.
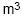 contém gás perfeito à temperatura de 27° C e à pressão de 996 Pa. O número de moléculas do gás no recipiente é
contém gás perfeito à temperatura de 27° C e à pressão de 996 Pa. O número de moléculas do gás no recipiente é