Questões de Concurso
Sobre transformações químicas em química
Foram encontradas 1.983 questões
Um exemplo de danos materiais (e também culturais) causado pela chuva ácida ocorre na Grécia, onde diversos monumentos históricos feitos de mármore foram danificados, forçando o governo a trocar algumas esculturas por réplicas. Os principais agentes da chuva ácida são óxidos do nitrogênio e do enxofre. Considere que 3,20 g de enxofre foram queimados em excesso de gás oxigênio, originando o óxido onde o enxofre se encontra em seu maior estado de oxidação. Tal óxido foi recolhido em quantidade suficiente de água em um erlenmeyer onde foi introduzido um pedaço de mármore de 10,00 g. Se todas as etapas do processo apresentam rendimento de 100 %, e apenas 80,0 % do mármore é formado por carbonato de cálcio, ao final da última reação, a massa de gás liberada, em g, foi de
O buraco na camada de ozônio era causado por gases conhecidos como CFC’s, os cloro-flúor-carbonos, que interferiam no equilíbrio existente entre o gás oxigênio e o ozônio. Analise as afirmações abaixo sobre o ozônio e o oxigênio.
I - A hibridação do oxigênio central do ozônio é sp2 e a geometria molecular é angular.
II - O ozônio e o gás oxigênio por serem formados pelo mesmo elemento, são isômeros.
III - As ligações entre os oxigênios são mais fracas no ozônio que no gás oxigênio.
IV - O ozônio e o gás oxigênio são conhecidos pelo forte caráter redutor.
Estão corretas as afirmativas
Uma definição muito comum e que possibilita tal medida é considerar que o raio atômico é a metade da distância entre os núcleos de átomos vizinhos de uma substância simples. Essa definição permite a determinação de raios atômicos para grande parte dos elementos, mas alguns deles não podem ter seus valores de raio determinados segundo essa metodologia, por não formarem substâncias simples com ligações entre os átomos. Um exemplo desses elementos é o
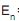 = –72,0/n2 , onde n é o número quântico principal. Considere a constante de Planck h = 4,14 × 10–15 e V.s e a velocidade de propagação da onda eletromagnética no vácuo c = 3,00 × 108 m/s. O comprimento de onda, em nm, de fótons provenientes da transição do nível n = 3 para o nível n = 2, propagando-se em um meio onde o índice de refração vale 2,00, é
= –72,0/n2 , onde n é o número quântico principal. Considere a constante de Planck h = 4,14 × 10–15 e V.s e a velocidade de propagação da onda eletromagnética no vácuo c = 3,00 × 108 m/s. O comprimento de onda, em nm, de fótons provenientes da transição do nível n = 3 para o nível n = 2, propagando-se em um meio onde o índice de refração vale 2,00, éI – Os raios catódicos são atraídos por uma chapa metálica ligada ao polo positivo de uma bateria.
II – A mudança dos gases no interior dos tubos não afeta a razão carga/massa dos raios catódicos.
III – A razão carga/massa dos raios canais é dependente do gás presente no interior das ampolas.
IV – Ao inverter a ligação dos polos da fonte com os eletrodos das ampolas, os raios catódicos se transformam em prótons.
Estão corretas APENAS as afirmativas
I – Adicionando-se HCl(aq) , ocorrerá evolução de H2(g) caso o sólido seja o carbonato de potássio.
II – Adicionando-se Na2S(aq) , ocorrerá precipitação, caso o sólido seja o cloreto de bário.
III – Adicionando-se H2O(l) e borbulhando-se CO2(g) , ocorrerá precipitação, caso o sólido seja óxido de sódio.
IV – Adicionando-se H2SO4(l) , ocorrerá evolução de ácido clorídrico, caso o sólido seja o cloreto de sódio.
Estão corretas APENAS as considerações
2KO2(s) + CO2(g) ? K2CO3(s) + 3/2 O2(g)
Se uma pessoa exala cerca de 1020,0 L de gás carbônico por dia, a quantidade de superóxido necessária para capturar todo o gás carbônico num período de três dias de viagem, em kg, é
Dado: Densidade do gás carbônico = 1,960 g/L
I – A quantidade de prata depositada na terceira cuba é 4,59 g.
II – Há produção de gás oxigênio apenas na segunda cuba.
III – A quantidade de ácido sulfúrico permanece constante na segunda cuba.
IV – O volume de oxigênio produzido, nas CNTP, na segunda cuba, é de 0,24 L.
Dado: Volume molar dos gases na CNTP = 22,4 L.mol –1
Estão corretas APENAS as afirmativas
O teste envolve a observação do composto CrO5 em fase orgânica, uma vez que esse composto é altamente instável em meio aquoso. Caso o solvente orgânico não seja adicionado, observam-se a coloração característica dos íons cromo III e a liberação de gás oxigênio.
A equação devidamente balanceada da reação entre as soluções de peróxido de hidrogênio e de dicromato de potássio em meio ácido, sem adição de solvente orgânico, é
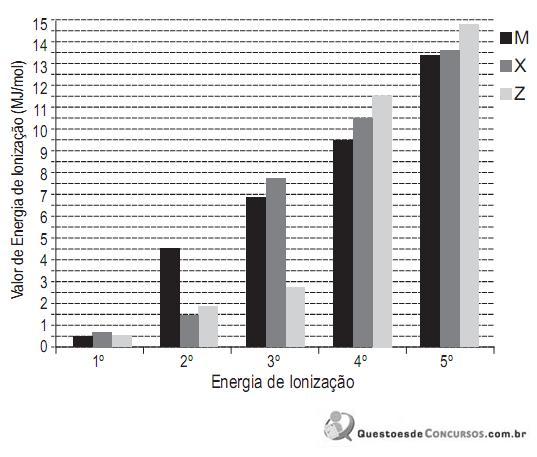
Analisando o gráfico, verifica-se que
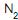 , de acordo com as CNTP. Durante um determinado instante, a corrente escoa a 27 oC e a 1 MPa, e o sensor indica uma vazão de 1 000 m3 /h. Se, posteriormente, a temperatura e a pressão dessa corrente aumentarem para 87 oC e 2 MPa, mantendo, no entanto, a vazão mássica constante, o valor medido pelo sensor sofrerá uma variação de
, de acordo com as CNTP. Durante um determinado instante, a corrente escoa a 27 oC e a 1 MPa, e o sensor indica uma vazão de 1 000 m3 /h. Se, posteriormente, a temperatura e a pressão dessa corrente aumentarem para 87 oC e 2 MPa, mantendo, no entanto, a vazão mássica constante, o valor medido pelo sensor sofrerá uma variação de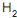 , uma corrente de 17 400 kg/h de gás natural (composição volumétrica: 90% de
, uma corrente de 17 400 kg/h de gás natural (composição volumétrica: 90% de 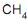 e 10% de
e 10% de 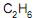 ) é misturada com vapor d´água de tal forma que a razão entre a quantidade de matéria de vapor e a quantidade de matéria total de carbono seja equivalente a 3. A vazão mássica da corrente de vapor é
) é misturada com vapor d´água de tal forma que a razão entre a quantidade de matéria de vapor e a quantidade de matéria total de carbono seja equivalente a 3. A vazão mássica da corrente de vapor é Dados: Massas molares: H = 1 kg/kmol; C = 12 kg/kmol; O = 16 kg/kmol

Estão corretas as associações
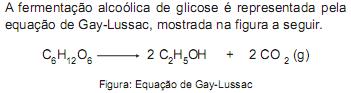
Assumindo que o gás carbônico tem comportamento ideal e que, em uma fermentação alcoólica, conduzida a 27 °C e a uma pressão de 1 atmosfera, foram gerados 2400 L desse gás, nas Condições Normais de Temperatura e Pressão (CNTP), este volume, em litros, corresponde a
Se essa reação for reproduzida em laboratório utilizando 0,98 g de ácido sulfúrico, e sabendo-se que as massas atômicas, em g/mol, são:
Na = 23, Cl = 35,45, S = 32,06, O = 16 e H = 1, as massas de ácido clorídrico e sulfato de sódio obtidas são, respectivamente,