Questões de Concurso
Sobre transformações químicas em química
Foram encontradas 1.983 questões
Em uma fermentação alcoólica, conduzida a uma temperatura igual a 86 °F e pressão igual a 1 atmosfera, foram formados 24.846 m3 de gás carbônico. A produção de álcool a partir de glicose é representada pela reação abaixo
C6 H12O6 → 2 C2 H5 OH + 2CO2 (g)
Considerando-se que o gás carbônico tem comportamento ideal, o volume do etanol formado, em m3 , é
Dados:
R: constante dos gases ideais;
R = 0,082 atm.L/mol.K;
ρ : densidade do etanol;
ρ = 0,8 g/cm3 ;
utilize o valor da temperatura considerando número inteiro

No pré-tratamento de material lignocelulósico por via ácida
empregando ácido sulfúrico, foram obtidos 200 m3 de
hidrolisado rico em pentoses. A concentração de ácido sul-
fúrico neste hidrolisado é igual a 2 x 10-2 mol/L. Visando a
aproveitar esse hidrolisado para a produção de etanol de
segunda geração a partir da fermentação das pentoses,
foi feito um tratamento por overliming, tendo sido utilizado
óxido de cálcio e empregando-se 25% de excesso deste
em relação à quantidade estequiométrica necessária para
a neutralização.
No pré-tratamento de material lignocelulósico por via ácida
empregando ácido sulfúrico, foram obtidos 200 m3 de
hidrolisado rico em pentoses. A concentração de ácido sul-
fúrico neste hidrolisado é igual a 2 x 10-2 mol/L. Visando a
aproveitar esse hidrolisado para a produção de etanol de
segunda geração a partir da fermentação das pentoses,
foi feito um tratamento por overliming, tendo sido utilizado
óxido de cálcio e empregando-se 25% de excesso deste
em relação à quantidade estequiométrica necessária para
a neutralização.
• sua afinidade eletrônica é a maior dentre as dos elementos de seu período da tabela periódica;
• a energia de ionização desse elemento é a segunda maior dentre as dos elementos de seu período da tabela periódica.
A fórmula química correta do composto iônico que contém o íon característico do elemento X é
Em um sistema gasoso, 2,0 mols de um gás considerado ideal ocupam um volume de 10 L a uma temperatura de 310 K. Se esse sistema gasoso sofresse compressão isotérmica, reduzindo seu volume a um quarto (1/4) do volume inicial, a pressão final do sistema gasoso seria igual, em atm, a:
Dado: R = 0,082 L.atm.mol-1 . K-1 = 8,31 J.K-1 .mol-1
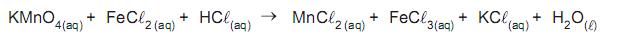
Com base nos coeficientes da equação balanceada, a proporção estequiométrica de reação entre as espécies KMnO4 e FeCl2 é
Substância Porcentagem
Sílica (SiO2 ).................................72%
Alumina (Al2 O3 ) .........................0,7%
Sulfato de sódio (Na2 SO4 ).........14%
Cal (CaO)..................................... 9%
Óxido de magnésio (MgO)............ 4%
Óxido de potássio (K2 O)...............0,3%
A respeito das substâncias que fazem parte da composição química do vidro, tem-se que
I - Obtenção de gelo seco a partir de gás carbônico
II - Queima de uma vela
III - Sal obtido a partir da água do mar
IV - O reflexo da luz solar em um lago
V- A formação da ferrugem em uma estrutura metálica São fenômenos obtidos por transformações químicas APENAS os apresentados em
6Fe2+(aq) + Cr2O72-(aq) + 14H+(aq) ? 6Fe3+(aq) + 2Cr3+(aq) + 7H2O(L)
Qual é a percentagem em massa de ferro na amostra?
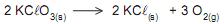
Sendo o volume molar igual 22,4 L/mol (na condição normal de temperatura e pressão), o volume máximo de oxigênio que pode ser obtido a partir da decomposição de 4,00 mol de KCLO3 , com o rendimento percentual de 90%, em L, é
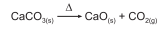
A quantidade máxima, em kg, de óxido de cálcio que se obtém a partir de 200 kg de calcário, contendo 90% em massa de carbonato de cálcio, é
Considere a hipótese de reação, unicamente na direção do produto, entre 5 mol de nitrogênio gasoso e quantidade suficiente de hidrogênio gasoso para o consumo total do N2 e formação de gás amoníaco, conforme a equação a seguir.
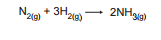
O volume máximo de NH3(g) , em litros, a ser obtido na CNTP é
Fe + O2 + H2O → Fe2+ + (OH)- → Fe(OH)2
Fe (OH)2 + O2 + H2O → Fe (OH)3
Sabe-se que, para um gás ideal, 1 mol equivale a 6,02 x 1023 moléculas e 22,4 L nas CNTP. Após realizar o correto balanço das equações desse processo corrosivo, conclui-se que, para produzir 10 mols de Fe (OH)3, nas CNTP, é necessário consumir

Sobre esses elementos, considere as afirmativas a seguir.
I – A quarta camada do elemento M está completamente preenchida.
II – J, Q e M são metais alcalinos.
III – X é um metal do grupo do carbono.
IV – Q e X são do mesmo período da Tabela Periódica.
Estão corretas APENAS as afirmativas
A percentagem de carbonato de cálcio, na amostra de calcário, considerando-se que, nas condições do experimento, o volume molar dos gases é de 25,0 L/mol e as impurezas presentes são inertes, é
Considere um recipiente de volume conhecido, conforme mostra a figura abaixo. Tal recipiente contém três válvulas (identificadas por Válv. 1, Válv. 2 e Válv. 3) e duas câmaras (nomeadas de P e Q) de medidas idênticas, conectadas por um cilindro. Todas as válvulas estão fechadas e o recipiente se encontra completamente vazio.

Ao se abrir a Válv. 1, admitem-se dois gases na câmara
P: 28 g de nitrogênio e 56 g de but-1-eno. Após a entrada
dessa quantidade dos gases, a Válv. 1 foi fechada. Nesse
momento, a temperatura do sistema era de 300 K, e a
pressão medida do sistema foi de

.
Considere um recipiente de volume conhecido, conforme mostra a figura abaixo. Tal recipiente contém três válvulas (identificadas por Válv. 1, Válv. 2 e Válv. 3) e duas câmaras (nomeadas de P e Q) de medidas idênticas, conectadas por um cilindro. Todas as válvulas estão fechadas e o recipiente se encontra completamente vazio.

Ao se abrir a Válv. 1, admitem-se dois gases na câmara
P: 28 g de nitrogênio e 56 g de but-1-eno. Após a entrada
dessa quantidade dos gases, a Válv. 1 foi fechada. Nesse
momento, a temperatura do sistema era de 300 K, e a
pressão medida do sistema foi de

.