Questões de Concurso
Comentadas sobre velocidade de reação, energia de ativação, concentração, pressão, temperatura e catalisador em química
Foram encontradas 294 questões
Julgue o item que se segue, acerca de modificações de superfícies de biomateriais com proteínas.
Todos os métodos de modificação de superfícies de
biomateriais são essencialmente métodos químicos.
Observe as seguintes afirmações sobre as condições para a ocorrência de reações químicas:
I - É necessário haver afinidade química entre os reagentes.
II - As colisões precisam ser favoráveis entre suas moléculas.
III - É necessário que a barreira energética dos reagentes seja superada por meio da Energia de ativação.
IV - Menor superfície de contato entre reagentes facilita as colisões.
Qual a alternativa CORRETA?
Acerca dos conceitos de cinética química, julgue o item.
Uma reação de ordem zero pode ser expressa como “velocidade = constante de velocidade”.
A lei de velocidade de uma reação é determinada experimentalmente e não pode, em geral, ser obtida a partir da equação química da reação.
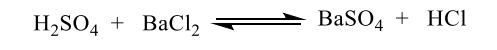
Com referência aos conceitos de equilíbrio químico, julgue o item.
O catalisador não altera a composição do equilíbrio químico.
Dada a reação hipotética:

A partir de dados experimentais, verifica-se que o composto A é um reagente de terceira ordem e a substância B é um reagente de primeira ordem da reação.
Se duplicarmos as concentrações dos reagentes A e B, a
velocidade dessa reação aumentará:
Sobre essa lei conclui-se que, para uma reação em meio gasoso, a constante de velocidade
A relação entre essas grandezas é expressa por
Em um experimento, realizou-se um estudo cinético da seguinte reação química:
2 N2 O5 (g) → 4 NO2 (g) + O2 (g)
Esse estudo indicou que essa é uma reação química de
primeira ordem e que a constante de velocidade é igual
a 3,4 x 10-4 s-1 a 25ºC.
Para uma concentração de N2
O5
igual a 0,2 mol L-1
, a
velocidade da reação, em mol L-1
s-1
, corresponde a
Em uma síntese industrial, o HBr é produzido a partir da seguinte reação química:
H2 (g) + Br2 (g) → 2 HBr (g)
No início da síntese, a concentração de H2
era de 0,3 mol/L.
Após 20 minutos, sua concentração passou a 0,1 mol/L.
Nesse intervalo de tempo, a velocidade média de formação de HBr, em mol L-1
min-1
, correspondeu a
No gráfico abaixo estão representados os caminhos de uma reação com catalisador e uma sem catalisador.
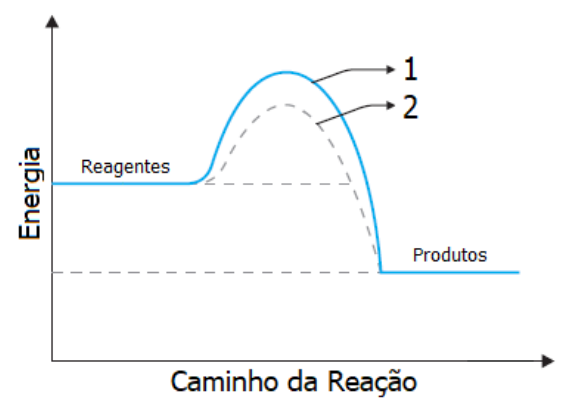
Identifique abaixo as afirmativas verdadeiras ( V ) e as falsas ( F ) com base nesse gráfico.
( ) A curva 1 refere-se à reação não catalisada e a curva 2 refere-se à reação catalisada.
( ) A energia de ativação da curva 1 é maior do que a da curva 2.
( ) A utilização de um catalisador na reação aumenta o valor de ∆H.
( ) O complexo ativado da curva 1 apresenta a mesma energia do complexo ativado da curva 2.
( ) Se a reação seguir o caminho da curva 2, ela será mais rápida.
Assinale a alternativa que indica a sequência correta,
de cima para baixo.
CuS + HNO3 ➔ Cu(NO3)2 + S + NO + H2O
Identifique abaixo as afirmativas verdadeiras ( V ) e as falsas ( F ) em relação à reação dada.
Assinale a alternativa que indica a sequência correta, de cima para baixo.
( ) A soma total de íons entre os produtos deve ser igual à soma total de íons entre os reagentes.
( ) O agente oxidante é o HNO3 e o agente redutor é o CuS.
( ) O total de elétrons cedidos pelo agente redutor deve ser igual ao total de elétrons recebidos pelo agente oxidante.
( ) Os coeficientes 3, 8, 3, 3, 2, 4 tornarão a equação balanceada.
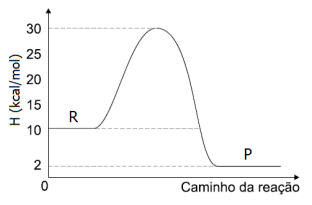
Identifique abaixo as afirmativas verdadeiras ( V ) e as falsas ( F ) com as informações fornecidas pelo gráfico.
( ) A energia dos reagentes é igual a 30 kcal/mol e a dos produtos é igual a 2 kcal/mol.
( ) O gráfico representa uma reação exotérmica onde são liberadas 8 kcal/mol de energia.
( ) A energia de ativação da reação é igual a 30 kcal/mol e a energia do complexo ativado é igual a 10 kcal/mol.
Assinale a alternativa que indica a sequência correta, de cima para baixo.
A seguir, julgue as assertivas abaixo:
I - A velocidade média de uma reação é a variação da concentração de uma espécie dividida pelo tempo que leva para que a mudança ocorra.
PORQUE
II - Na velocidade média única, dizem que é a velocidade média dividida pelos coeficientes estequiométricos das espécies monitoradas. Estas técnicas espectroscópicas são muito usadas para estudar as velocidades de reação, em especial nas reações rápidas.
É correto o que se afirma em:
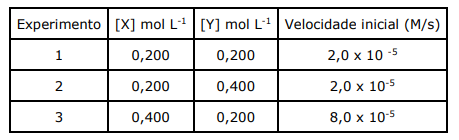
Com base nos dados da tabela, analise as assertivas abaixo:
I. A lei de velocidade para a reação é v= k [X]2 .
II. A concentração de Y não tem nenhum efeito sobre a velocidade da reação.
III. A ordem global da reação é 3.
IV. A constante de velocidade da reação é 2,0 x 10-3 M-1s-1.
Quais estão corretas?
Tabela: Dados obtidos na investigação cinética (método da velocidade inicial) para a reação: 2 A2B(g) → 2 A2(g) + B2(g).
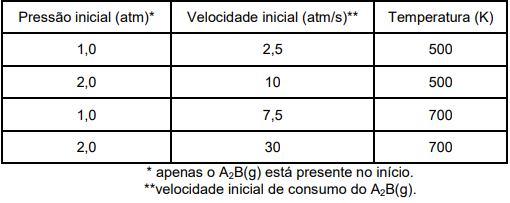
Diante das informações acima, assinale a opção que mostra A VELOCIDADE DA REAÇÃO (em termos de consumo do A2B(g)), em atm/s, quando a pressão de A2B(g) é igual a 1,5 atm à temperatura de 600 K: