Questões de Concurso Público CEFET-RJ 2014 para Técnico de Laboratório - Química
Foram encontradas 20 questões
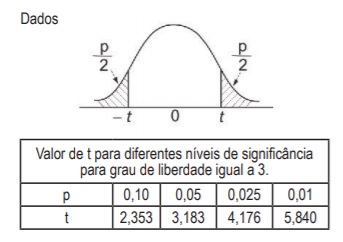
Réplica 1 2 3 4 5 Resultado (em μg.g-1) 10,5 10,4 10,5 10,5 10,6
Se o resultado verdadeiro para o analito na amostra é 10,0 µg . g-1 , é possível concluir que o(a)
determinada por diferença em relação à massa do balão vazio.
O resultado médio de quatro réplicas do experimento para um mesmo balão foi 24,975 g com desvio padrão de 0,081 g.
Considerando distribuição estatística dos dados tendendo à normalidade, o volume máximo do balão (em mL), com 95% de limite de confiança, é mais próximo de
O funcionamento apropriado desse tipo de eletrodo depende de
A absorvância é
I - As Frases de Risco (Frases R) comunicam uma descrição geral das características físico-químicas, ambientais e de risco à saúde de uma substância.
II - As Frases de Segurança (Frases S) fornecem informação sobre o armazenamento, disposição, primeiros socorros e proteção.
III - Perigo é a propriedade inerente da fonte, situação ou ato com potencial para provocar danos aos humanos em termos de lesão, doença ou combinação destas.
Está correto o que se afirma em:
Com base nessas informações, conclui-se que a(o)

Observe as afirmações a seguir relativas à preparação de soluções e aos cuidados com o uso de balões volumétricos.
I - A incerteza relativa de um balão volumétrico classe A diminui com o aumento do volume do mesmo.
II - O erro de paralaxe no ajuste de volume é causado pelas variações de temperatura que afetam o coeficiente de dilatação do vidro.
III - Um balão volumétrico pode ser resfriado previamente na geladeira para aumentar a estabilidade da solução preparada.
Está correto o que se afirma em:
Dessa forma, a água
I - Tal medição requer o manuseio das amostras com pinças ou aparatos a?ns de modo a evitar o contato das mãos com o material que será pesado.
II - Tal medição requer o uso de balança calibrada com pesos padrões e nivelada.
III - Tal medição requer o uso de balança cuja escala apresente apenas uma casa decimal do grama.
Está correto o que se afirma em
Soluções Cor da solução na presença Cor da solução na presença Cor da solução na presença
azul de bromotimol de alaranjado de metila de fenolftaleína
1 amarela vermelha —
2 azul amarela —
3 amarela amarela incolor
4 verde — incolor
De acordo com os resultados, o técnico concluiu que as soluções 1, 2 , 3 e 4 eram, respectivamente,
Dados
cores dos indicadores em diferentes faixas de pH (valores aproximados).
Azul de bromotimol Alaranjado de metila Fenolftaleína
pH < 6,0 – cor amarela pH ≤ 3,1 – cor vermelha pH < 8,2 – incolor
pH entre 6,0 e 7,6 – cor verde pH entre 3,2 e 4,4 – cor laranja pH entre 8,2 e 10,0 – cor rosa claro
pH > 7,6 – cor azul pH > 4,4 cor amarela pH > 10 cor rosa intenso
• H2 SO4
• HCl
• NaOH
• etano
•hexano
• Ca(OH) 2
• H2 O2
• acetonitrila
• metanol
NÃO devem ser estocados na mesma prateleira de um armário
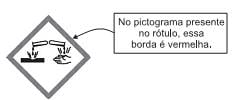
Esse pictograma indica que a substância é
Esse processo é conhecido como
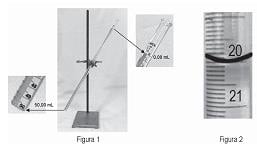
Acrescentou água até a marcação indicada na Figura 2, fez a leitura para chegar ao volume contido e constatou que o valor do erro relativo percentual na medida do volume contido, levando em conta a leitura a partir do menisco inferior, é, aproximadamente,
A massa, em gramas, de PbI 2 , sólido que se forma ao se misturarem 100,00 mL de cada uma das soluções, é
Dados M(KI) = 166 g/mol M(Pb(NO3)2) = 331 g/mol M(Pbl2) = 461 g/mol
KHC8 H4 O4(aq) + NaOH(aq) → KNaC8 H4 O4(aq) + H2 O(l)
A solução aquosa de NaOH a ser padronizada e a água usada na preparação do padrão primário foram tratadas para ficar isentas de CO2 dissolvido. Em pesa-filtro de forma baixa pesaram-se 7,4245 g de biftalato de potássio. A essa massa foi adicionada água suficiente para a sua dissolução total de forma que o padrão primário fosse transferido quantitativamente para balão volumétrico de 250,00 mL, onde o volume foi ajustado até o traço de referência pela adição de água. Uma alíquota de 25,00 mL dessa solução foi titulada com a solução de NaOH, usando a fenolftaleína como indicador do ponto final.
Sendo o volume da solução aquosa de NaOH gasto na titulação, até a mudança de cor da fenolftaleína para rosa claro, igual a 22,78 mL, a concentração em quantidade de matéria (mol/L) da solução de NaOH é
Dado M(KHC8H4O4) = 204,23 g/mol
1o ) Transfira uma solução padrão de permanganato de potássio 0,5000 mol/L para uma bureta limpa e seca.
2o ) Pipete 25,00 mL de amostra de água oxigenada comercial para um balão volumétrico de 250,00 mL, acrescente água destilada até o traço de referência e faça a homogeneização. Dessa solução, pipete uma alíquota de 25,00 mL para um frasco Erlenmeyer, acrescente ±100 mL de água destilada e 5 mL de ácido sulfúrico concentrado.
3o ) Titule o H2 O2 contido na alíquota com a solução padrão de permanganato de potássio até coloração levemente violeta (1o excesso de KMnO4 ).
A reação que ocorre na titulação é:
2 MnO4 - (aq) + 5 H2 O2(aq) + 6 H+ (aq) → 2 Mn2+ (aq) + 5 O2(g) + 8 H2 O(l)
Seguindo esse roteiro, o volume de solução de permanganato de potássio gasto na titulação da alíquota no frasco Erlenmeyer foi igual a 30,40 mL.
Com base nos resultados da análise, o técnico constatou que a porcentagem massa por volume (g H2 O2 /100 mL água oxigenada) na amostra original é igual a
Dado M(H2O2) = 34,00 g/mol
HC2 H3 O2(aq) + H2 O(l)
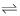 H3 O+ (aq) + C2 H3 O2 - (aq)
H3 O+ (aq) + C2 H3 O2 - (aq) Com o objetivo de estudar a variação do valor do pH (capacidade freadora ou de tamponamento) dessa solução, um técnico fez experiências adicionando a três alíquotas da solução um volume específico das seguintes substâncias: (i) água pura, (ii) uma solução aquosa de base forte e (iii) uma solução aquosa de ácido forte.
Considerando esse equilíbrio e as condições externas que podem perturbá-lo até que se atinja um novo equilíbrio, constata-se que na adição de 10,0 mL de