Questões de Concurso Público PC-PB 2022 para Perito Oficial Químico Legal - Área Química
Foram encontradas 80 questões
O oxigênio representa aproximadamente 20% (em volume) do ar atmosférico em relação aos outros gases presentes na mistura. Quando o oxigênio e o monóxido de carbono se encontram, ocorre a seguinte reação química.
CO (g) + ½ O2 (g) → CO2 (g)
Nessa situação, considerando que todos os gases estejam submetidos à mesma pressão e temperatura, o volume de ar necessário para a combustão completa de 20 L de monóxido de carbono é
Considere as equações químicas a seguir.
I NH3 + H2O ⇌ NH4+ + OH−
II Cu2+ + 4 NH3 ⇌ [Cu(NH3)4] 2+
III 2 Fe3+ + Sn2+ ⇌ 2 Fe2+ + Sn4+
Ocorre reação de oxirredução apenas na(s) equação(ões)
O BCAA (do inglês branch chain amino acids) é um importante suplemento alimentar que participa da síntese de proteínas musculares. A valina é um dos aminoácidos presentes na sua composição. A equação a seguir mostra a ionização da valina em meio aquoso.
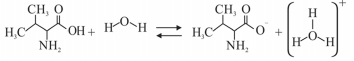
Considerando as informações precedentes, assinale a opção
correta.
Amidas são compostos que têm a estrutura genérica:
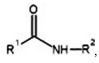
em que R1 e R2 representam cadeias carbônicas. Esses compostos podem ser preparados pela reação entre um ácido carboxílico e uma amina, tal como ilustrado na equação a seguir, a qual representa uma reação entre os aminoácidos glicina e cisteína que produz o composto A.
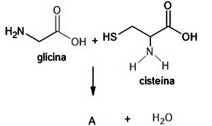
Acerca desse assunto e considerando que MH = 1 g/mol;
MC = 12 g/mol; MN = 14 g/mol; MO = 16 g/mol; MS = 32 g/mol,
assinale a opção correta.
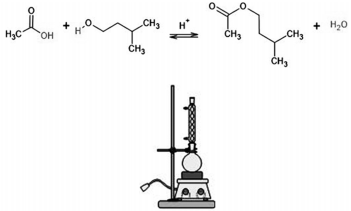
Os ésteres estão presentes em composições de flavorizantes para adição em alimentos. Essas substâncias não fazem ligações de hidrogênio. Tanto no laboratório quanto na indústria, eles são facilmente preparados pela reação entre um ácido carboxílico e um álcool. As figuras precedentes mostram a reação química da síntese do acetato de isoamila e o sistema de reação utilizado nessa síntese.
Considerando essas informações, assinale a opção correta.
Na figura a seguir é esboçado o gráfico do fator de compressibilidade dos gases genéricos A e B, em função da pressão, sob temperatura ambiente.
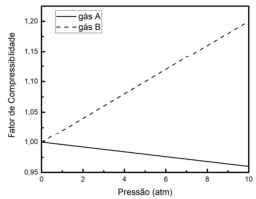
Em relação ao gás A, sob temperatura ambiente e na faixa de
pressões mostrada, o gás B apresenta
A cinética de decomposição do brometo de nitrosila em óxido nítrico e bromo, conforme equação química mostrada a seguir, pode ser expressa pela lei de velocidade d[NOBr]/dt = −kˑ[NOBr]2 , em que [NOBr] representa a concentração de brometo de nitrosila em mol/L; t, o tempo de reação em segundos; e k, a constante cinética do processo.
2 NOBr (g) → 2 NO (g) + Br2 (g)
Sob condições experimentais, em que a constante cinética da reação em apreço vale 2 L ˑ mol−1 ˑ s−1, assinale a opção que corresponde ao tempo de meia vida do processo quando se parte de uma concentração de 0,1 mol/L de brometo de nitrosila.