Questões de Concurso Público Prefeitura de São José - SC 2018 para Professor - Química
Foram encontradas 30 questões
1. O projeto diz respeito à concepção de escolas socialmente determinadas e referidas ao campo educativo. 2. O projeto serve de referência à ação exclusiva dos agentes que atuam na gestão e que intervêm no ato educativo. 3. O desenvolvimento do projeto implica a existência de um direcionamento e forte atuação da gestão escolar para descrever um documento orientador das práticas a serem desenvolvidas na escola.
Assinale a alternativa que indica todas as afirmativas corretas.
1. Acesso, permanência e sucesso das crianças, adolescentes, jovens e adultos na escola. 2. Gestão democrática do sistema de ensino, ou seja, concepção e proposta de como lidar com as relações de poder que perpassam todas as instâncias e fóruns do sistema, desde a sala de aula, a direção da escola, os conselhos e o órgão central. 3. Qualidade de ensino, que requer uma proposta curricular, bem como todas as condições necessárias para a sua concretização: valorização dos profissionais, formação permanente, condições materiais de trabalho, entre outras.
Assinale a alternativa que indica todas as afirmativas corretas.
1. Domínio da leitura, da escrita e do cálculo. 2. Compreensão do ambiente natural e social, do sistema político, da tecnologia, das artes e dos valores em que se fundamenta a sociedade. 3. Desenvolvimento da capacidade de ensino, tendo em vista a aquisição de conhecimentos científicos e sua capacidade de transmissão. 4. Fortalecimento dos vínculos de família, dos laços de solidariedade humana e de tolerância recíproca em que se assenta a vida social.
Assinale a alternativa que indica todas as afirmativas corretas.
A partir dessa descrição, é correto afirmar que esta prática pedagógica enquadra-se mais fortemente em qual concepção de educação?
Quando o dicromato de sódio, Na2 Cr2 O7 , numa reação química se transforma em sulfato de crômio, Cr2 (SO4 ) 3 , cada átomo de crômio:

A partir dos dados extraídos do gráfico responda aos itens abaixo:
Admitindo-se que, para uma certa reação, o segmento AB representa o nível da entalpia dos reagentes e o segmento FG o nível da entalpia dos produtos, podemos afirmar que:
1. A reação direta é exotérmica.
2. A energia de ativação desse processo é representada pelo segmento FG. 3. O perfil do gráfico permite afirmar que a reação direta representa uma reação de combustão. 4. A variação de entalpia (energia) de reação direta é de ΔH = – 600,00 kJ. 5. A reação inversa é exotérmica.
Assinale a alternativa que indica todas as afirmativas corretas.
Analise as afirmativas a seguir:
1. A massa atômica de certo elemento que é apresentada na tabela periódica corresponde à média ponderal das massas atômicas dos seus isótopos naturais.
2. Os nêutrons são partículas subatômicas com carga positiva e têm aproximadamente a mesma massa do elétron.
3. Os isótopos de um elemento têm o mesmo número atômico, mas diferentes números de massa.
4. Para um elemento neutro, a soma do número de prótons e de nêutrons corresponde ao seu número de massa.
5. A disposição dos elementos na tabela periódica está baseada no número atômico do elemento que corresponde à soma dos seus prótons e de seus elétrons.
Assinale a alternativa que indica todas as afirmativas corretas.
Considere certa reação química, representada pela equação genérica abaixo:
A + B → Produtos
Na temperatura de 20°C, apresenta um lei de velocidade (V1 ), V1 = k.[A].[B].
Qual será a sua lei de velocidade (v2 ) na temperatura de 30°C, admitindo-se que essa reação obedece ao princípio de Van’t Hoff, nas mesmas concentrações iniciais dos reagentes.
Considerando os seguintes dados, calcule o calor de combustão do etino, C2 H2, conhecido comercialmente como acetileno.
2C(grafite) + H2 (g) → C2 H2 (g) ∆Hf0 = +226,73 kJ.mol–1
C(grafite) + O2 (g) → CO2 (g) ∆Hf0 = –393,51 kJ.mol–1
H2 (g) + ½O2 (g) → H2 O(l) ∆Hf0 = –285,83 kJ.mol–1
O calor de combustão do acetileno, (∆Hr0 ), é:
Num reator em forma de balão com capacidade de 1,0 litro, numa temperatura de 100,0°C, foram adicionados 1,0 mol de H2 (g) e 1,0 mol de I2 (g).
A figura abaixo apresenta a variação das concentrações com o tempo de H2 (g), I2 (g) e de HI(g).
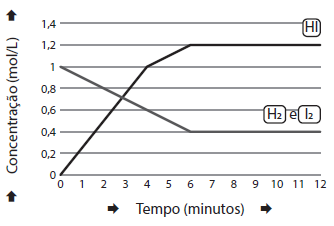
A reação é representada pela equação:
H2
(g) + I2
(g) → 2HI(g)
O valor da constante de equilíbrio é igual a:
dentifique abaixo as afirmativas verdadeiras ( V ) e as falsas ( F ).
( ) De acordo com o princípio da conservação da energia, a energia não pode ser criada nem destruída, mas somente transformada de uma espécie em outra.
( ) O estado de equilíbrio químico ocorre no momento em que o sistema reacional estaciona e a reação é completada.
( ) Aproximadamente 1,3 kW m-2 da energia radiante solar atinge a Terra, porém somente cerca de 5% desta energia é convertida em carboidratos pela fotossíntese.
( ) Denomina-se “processo exotérmico” aquele que absorve calor e apresenta ∆H > 0.
( ) Aumentar a quantidade dos reagentes é a única maneira de se elevar o valor da constante de equilíbrio de uma reação química.
Assinale a alternativa que indica a sequência correta, de cima para baixo.