Questões de Concurso Público FIOCRUZ 2010 para Tecnologista em Saúde - Farmacocinética
Foram encontradas 60 questões
I. Resíduos infectantes são aqueles que contém agentes biológicos com risco potencial à saúde pública e ao ambiente.
II. Resíduos especiais incluem os resíduos radioativos, farmacêuticos e químicos perigosos.
III. Resíduos de baixa radioatividade e tempo de meia vida curta podem ser estocados até o decaimento da radioatividade para níveis em que não sejam mais considerados radioativos.
IV. O rejeito de resíduos biológicos deve ser acondicionado em sacos plásticos de cor preta.
Assinale:
(Allen Jr, Loyd V. Ansel H.C. Formas Farmacêuticas e Sistemas de Liberação de Fármacos, 8ª edição, 2007- com adaptações)
Em uma preparação farmacêutica aquosa de grande volume, é mais adequado utilizar a esterilização:
I. A notificação voluntária é classificada como um processo de vigilância passiva e as instituições sentinela são classificados como vigilância ativa.
II. Conceitos e métodos epidemiológicos são utilizados na farmacovigilância.
III. A notificação de suspeita de reação adversa só deve ser realizada, quando da certeza de que a reação ocorreu devido ao uso de um medicamento.
IV. A avaliação da causalidade só pode ser realizada por meio do uso de algoritmos.
Assinale:
I. referências oficializadas pela Farmacopéia Brasileira.
II. padrões secundários, desde que a identidade e o teor sejam devidamente comprovados.
III. substâncias sintetizadas em laboratório de pesquisa com alto índice de recuperação.
IV. o sal do princípio ativo utilizado na produção do medicamento.
Assinale:
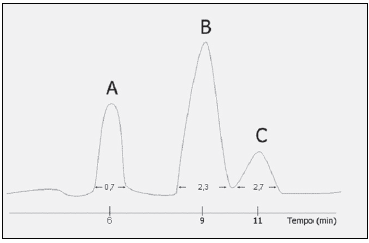
I. caso o método seja destinado à quantificação de mais de um fármaco, todos devem ser injetados para determinar os tempos de retenção.
II. deve-se analisar amostras de branco da matriz biológica obtidas de oito indivíduos, sendo seis amostras normais, uma lipêmica e uma hemolisada.
III. os resultados das amostras de branco devem ser comparados com aqueles obtidos com solução aquosa do analito, em concentração próxima ao limite superior de quantificação.
IV. os interferentes podem ser componentes da matriz biológica, metabólitos, produtos de decomposição e medicamentos utilizados concomitantemente ao estudo.
Assinale: