Questões de Concurso Público SME - SP 2023 para Professor de Ensino Fundamental II e Médio - Química
Foram encontradas 60 questões
O trecho acima discorre sobre a influência dos ambientes institucionais na construção das diferenças, o que inclui a escola. Assinale a opção correta segundo a perspectiva apresentada.
Assinale a opção que destaca corretamente o que é afirmado acima.
Com base na concepção de inclusão da autora, assinale a afirmativa que caracteriza corretamente sua proposta para uma “ética da inclusão”.
“No Brasil, a negação do racismo e a ideologia da democracia racial sustentam-se pelo discurso da meritocracia.” ALMEIDA, Silvio. Racismo Estrutural. São Paulo: Pólen, 2017.
Em relação ao modo como as questões raciais impactam e são impactadas pelos métodos escolares de avaliação, é correto afirmar que
Para enfrentar este desafio, a lei visa a
A respeito da concepção defendida por este autor, é correto afirmar que a avaliação deve
Segundo essa perspectiva, é correto afirmar que
om base no trecho, assinale a opção que interpreta corretamente a concepção de conduta docente de Paulo Freire.
A análise elementar de uma amostra revelou a seguinte composição: 58,5% de carbono, 4,1% de hidrogênio e 11,4 % de nitrogênio.
[Dados: massas molares (em g.mol-1): C: 12; H: 1; N: 14; O: 16.]
A fórmula mínima do composto na amostra é
[Dados: massas molares (em g.mol-1). Metano: 16; Amônia: 17.]
Nesse caso, é correto afirmar que os recipientes contêm
[Dados. Potenciais de redução padrão:
E0Al3+|Al = -1,66 V; E0Cu2+|Cu = +0,34 V.]
Nessas condições, analise as afirmativas a seguir a respeito desse sistema eletroquímico:
I. Será uma pilha, pois a reação esperada é espontânea. II. A diferença de potencial esperada é 7,32V. III. Será uma reação espontânea se um potencial externo de 2,00V for aplicado ao sistema.
Está correto o que se afirma em
Considere os dados termoquímicos:
B2H6(g) + 3 O2(g) → B2O3(s) + 3 H2O(g) ΔHo= -1941 kJ mol–1 2 B(s) + 3/2 O2(g) → B2O3(s) ΔHo= -2368 kJ mol–1 H2(g) + 1/2 O2(g) → H2O(g) ΔHo= -241,8 kJ mol–1
A entalpia padrão de formação do diborano (em kJ mol–1) é
A esse respeito, assinale V para a afirmativa verdadeira e F para a falsa.
( ) Hidroxiacetona, etanoato de metila e ácido propanoico são isômeros. ( ) Hidroxiacetona, etanoato de metila e ácido propanoico apresentam grupos polares em suas estruturas. ( ) Pontos de ebulição dos compostos seguem a ordem: etanoato de metila > ácido propanoico ≈ hidroxiacetona.
As afirmativas são, respectivamente,
A fórmula química que representa sua estrutura é apresentada abaixo:
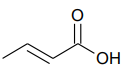
Uma solução aquosa de ácido crotônico foi preparada pela dissolução de 2,15g do ácido em água, sendo o volume final igual a 500mL.
[Dados: massas molares (em g.mol-1). C: 12; H: 1; O: 16.]
O pH dessa solução é igual a
1. A quantização do momento angular. 2. O equilíbrio mecânico atingido pela igualdade dos módulos das forças elétrica (de atração do elétron ao núcleo) e centrípeta (do movimento circular do elétron em torno do núcleo).
Dessa forma, ele desenvolveu uma expressão para a energia que depende de um número quântico, n, que indica o nível de energia eletrônica e determina o raio.
A esse respeito, assinale V para a afirmativa verdadeira e F para a falsa.
( ) O modelo atômico de Bohr permitiu descrever com sucesso o raio do movimento circular do elétron em torno do núcleo de hidrogênio no estado fundamental. ( ) O modelo atômico de Bohr permitiu descrever com sucesso a diferença de energia entre dois níveis eletrônicos do átomo de hidrogênio. ( ) O modelo atômico de Bohr permitiu descrever com sucesso o comprimento de onda associado a excitações eletrônicas em átomos de qualquer número atômico.
As afirmativas são, respectivamente,
Entretanto, observa-se que, contrário à regra, os valores daprimeira energia de ionização dos átomos nitrogênio (Z = 7) eoxigênio (Z = 8) mostram EI(O) < EI(N):
• EI(N) = 1402 kJ mol-1 • EI(O) = 1314 kJ mol-1
Assinale a opção que justifica corretamente a relação entre osvalores de EI do nitrogênio e do oxigênio.
A Cipermetrina é uma substância do grupo dos piretróides e possui classificação toxicológica nível II (altamente tóxica). É fotoestável, não se degradando com a luz solar. Atua como um potente inseticida, por contato ou ingestão, contra alvos biológicos que causam consideráveis danos a culturas como algodão, café, milho e soja.
A fórmula que representa a estrutura química da cipermetrina é mostrada a seguir.
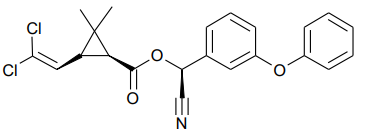
Nessa estrutura, é possível identificar os grupos funcionais
A série do tório, por exemplo, inicia-se pela sequência:
• 232Th90 → 228Ra88 + α • 228Ra88 → AXZ + β • AXZ → 228Th90 + β
O produto da segunda equação química é um núcleo