Questões de Concurso Público Prefeitura de São José - SC 2019 para Engenheiro - Químico
Foram encontradas 5 questões
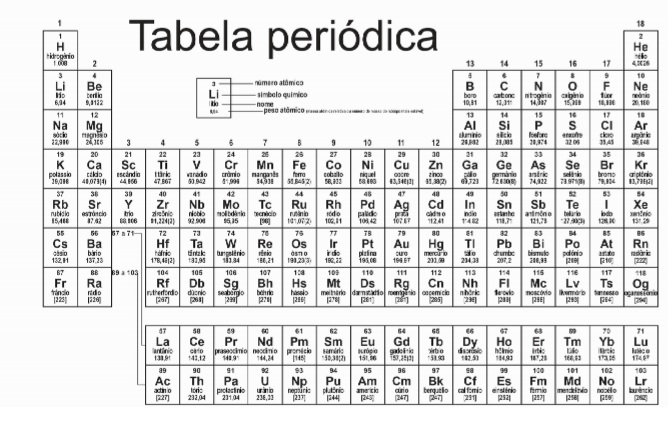
A reação que ocorre é: Ag2S(s) + Aℓ(s)→ Aℓ2S3(s) + Ag(s)
Utilizando o processo descrito, a massa de prata metálica que será regenerada na superfície de um objeto que contém 5g de sulfeto de prata I é aproximadamente: