Uma amostra impura de calcário contendo areia (CaCO3 + Si...
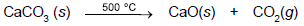
Considerando-se que a areia permaneceu sem reagir durante todo o procedimento de análise, o teor percentual de CaCO3 na amostra impura de calcário é
- Gabarito Comentado (1)
- Aulas (13)
- Comentários (3)
- Estatísticas
- Cadernos
- Criar anotações
- Notificar Erro
Gabarito comentado
Confira o gabarito comentado por um dos nossos professores
Massa da amostra de calcário contendo areia = 50 g;
Massa de CO2 liberado = 11 g;
Massa atômica dos elementos (de acordo com a tabela periódica): Ca = 40,0 u; C = 12,0 u; O = 16,0 u.
Resolução:
MM (CO2) = 12,0 + 2 ∙ 16,0 = 44,0 g/mol
2) A partir das massas molares tem-se a quantidade em massa envolvida na reação, logo:
1 mol de CaCO3 produz 1 mol de CO2
100 g de CaCO3 produz 44 g de CO2
X ------ 11,0
X = 11 ∙ 100/44 = 100/4 = 25 g de CaCO3
3) Para formar 11 g de CO2 são necessários 25 g de CaCO3. Sabe-se, portanto, que 25 g da amostra que possui massa total de 50 g corresponde de fato ao CaCO3. Para saber a porcentagem de CaCO3 basta realizar uma regra de três simples:
25 -------------- X
X = 50 ∙ 100/25 = 50% de CaCO3
Gabarito do Professor: Letra C.
Clique para visualizar este gabarito
Visualize o gabarito desta questão clicando no botão abaixo
Comentários
Veja os comentários dos nossos alunos
CaCO3-----------CO2
1mol--------------1mol
100g/mol--------------44g/mol
x-------------------------- 11 g
x= 25g
pureza=massa pura/massa amostra x100
25/50 X100 = 50%
massa molar:
CaCO3=100g
CO2=44g
regra de três:
100g-----44g
x -----11g
X=25g
------------------
50g----100%
25g----X
X=50%
A pior parte de fazer uma questão deste tipo é errar por falta de atenção na aritmética básica na ultima conta. Errei na divisão de 1100/44, dá uma desanimada assim. Mas bola para frente
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo