De acordo com os dados da tabela abaixo de velocidade para a...
De acordo com os dados da tabela abaixo de velocidade para a reação dos íons amônio e nitrito em água a 25ºC:
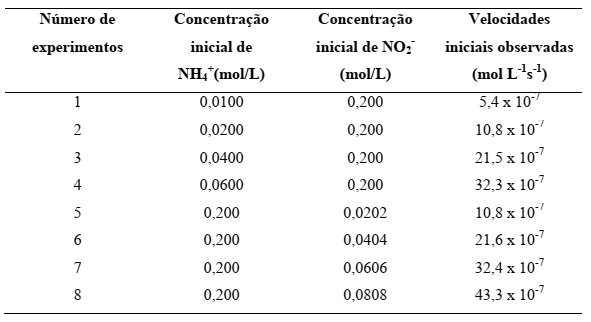
Podemos afirmar que a velocidade para [NH4
+
] = 0,100 mol/L e [NO2
-
] = 0,100 mol/L em mol
L
-1
s
-1
é:
Comentários
Veja os comentários dos nossos alunos
GABARITO A*
Precisamos de três observações:
1°) Identificar a ordem da reação: V = k [NH] [NO]
Analisando o experimento 1 e 2: [NO ] é mantida constante e [NH ] dobra. Observa-se que a velocidade também dobra de valor. Isso significa uma relação direta, ou seja, o valor de n=1
Analisando o experimento 5 e 6: [NH ] é mantida constante e [NO ] dobra. Observa-se que a velocidade também dobra de valor. Isso significa uma relação direta, ou seja, o valor de m=1
Lei de Velocidade: V = k [NH] [NO]
2°) Calcular o valor da constante de velocidade: Para isso podemos escolher qualquer um dos experimentos, por exemplo, o primeiro:
V = k [NH] [NO]
k = [NH] [NO]/V
k =(0,0100) (0,200)/(5,4 x 10)
k = 2,7 x 10, L mol s
3°) Calcular a velocidade: Para os seguintes valores,
[NH ] = 0,100 mol/L
[NO ] = 0,100 mol/L
k = 2,7 x 10, L mol s
teremos:
V = k [NH] [NO]
V = (2,7 x 10) x (0,100) x (0,100)
V = 2,7 x 10 mol L s
*A unidade de velocidade é "mol L s", até mesmo o enunciado cita "mol L s", mas nas alternativas tem apenas a unidade "mol/L"
De qualquer forma segue o jogo!
v =k.[NH4+].[NO2-]
5,4 . 10^-7 = k . 0,2 . 0,01
k = 2,7 . 10^-4
v = 2,7 . 10^-4 . [0,100] . [0,100]
v = 2,7 . 10^-6
GAB:A
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo