Foi requisitado a um técnico de laboratório que preparasse u...
Foi requisitado a um técnico de laboratório que preparasse uma solução de hidróxido de amônio, a partir de uma solução comercial concentrada, cujo rótulo contém as informações ao lado:
Dados: MM(NH3) = 17g/mol
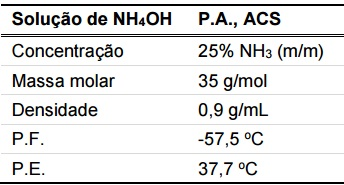
Assinale a alternativa que indica o volume aproximado da solução
comercial (em mL) que o técnico deve utilizar para obter 5 litros de
uma solução de NH4OH 1 mol/L.
Comentários
Veja os comentários dos nossos alunos
Dado que T (%) de NH4OH = 75 %
MOLARIDADE INICIAL
Mi = ( 1000 x d x T%) / MM
Mi = ( 1000 x 0,9 x 0,75 ) / 35
Mi = 675 / 35
Mi = 19,285 mol/L
VOLUME INICIAL
Mi x Vi = Mf x Vf
19,285 x Vi = 1 x 5
Vi = 19,285 / 5
Vi = 385 mL
Vi = 378 mL (aproximadamente)
ALTERNATIVA C !!!!!!
CONCENTRAÇÃO DADA: % NH3= 25% (m/m)
NH3 + H20 = NH4OH
25g /17 g/mol = 1,47 mol
1 mol de NH3 irá formar 1 mol NH4OH, então num. de mols de NH4OH = num. mols de NH3 = 1,47mols
Pela densidade: 0,9 = 100/V => V= 111mL
Molaridade da solução concentrada => M = 1,47/ 0,111 = 13,24 mol/L
Mi . Vi = Mf . Vf
13,24 . Vi = 1 . 5
Vi = 0,378 mL = 378 L
ALTERNATIVA C!
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo