O teor de grupos funcionais básicos em um carbono ativado fo...
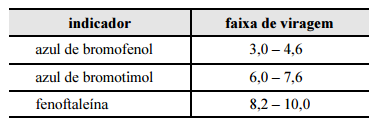
Considerando a situação descrita e a tabela apresentada, que contém faixas de viragem de diferentes indicadores, julgue o item subsequente.
Para preparar 500 mL de uma solução de HCl com concentração 0,100 mol/L, o volume V de solução estoque necessário, em mL, pode ser calculado por meio da equação a seguir, em que MHCl , C% e d representam, respectivamente, a massa molar do HCl (em g/mol), a concentração (em porcentagem massa/massa) e a densidade (em g/mL) da solução estoque.
V= [5 . MHCl / (C% . d)] . mol . %
- Gabarito Comentado (1)
- Aulas (19)
- Comentários (5)
- Estatísticas
- Cadernos
- Criar anotações
- Notificar Erro
Gabarito comentado
Confira o gabarito comentado por um dos nossos professores
VHCl = 500 mL = 0,5 L;
CMHCl = 0,100 mol/L.
Resolução:
1) Como o número de mols (n) de HCl tem que ser o mesmo na solução concentrada (solução estoque) e na solução a ser preparada (solução diluída), temos que:
nHCl (sol. diluída) = nHCl (sol. estoque)
CMHCl (sol. diluída) ∙ VHCl (sol. diluída) = CMHCl (sol. estoque) ∙ VHCl (sol. estoque)
Substituindo os valores, obtemos a seguinte expressão:
0,1 ∙ 0,5 = CMHCl (sol. estoque) ∙ VHCl (sol. estoque)
VHCl (sol. estoque) = 0,05 (mol)/CMHCl (sol. estoque) (mol/mL)
2) Para saber se a expressão do enunciado está correta, basta checar suas unidades e relacioná-la à expressão mostrada acima:
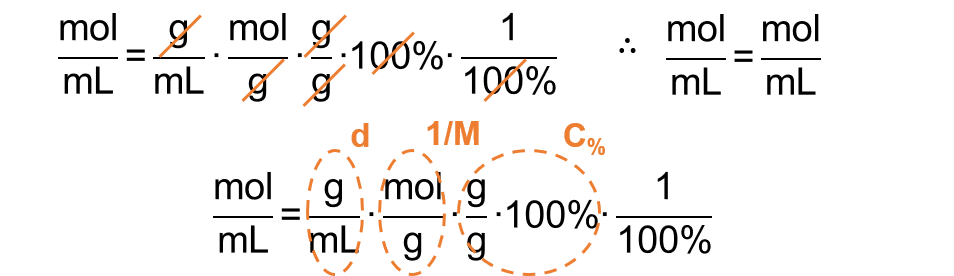
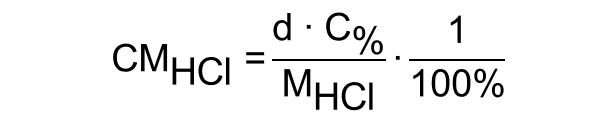
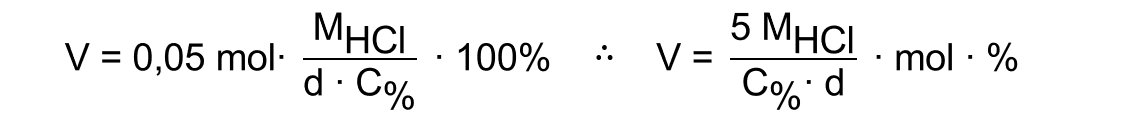
Gabarito do Professor: CERTO.
Clique para visualizar este gabarito
Visualize o gabarito desta questão clicando no botão abaixo
Comentários
Veja os comentários dos nossos alunos
Temos que fazer análise dimensional nesta questão, após simplicar as unidades, sobrará apenas o volume em mL.
Alguém pode explicar melhor?
a questão pede nada mais do q uma interpretação das grandezas.
então vamos substituir as grandezas na formula dada, e ir cortando:
((5 x (g/mol)) / ((g/g) x (g/mL))) x mol x % = 0,05 mL.100% =5mL
( numerador / denominador )
Meu raciocínio:
quero preparar 500 mL de uma solução 0,1 mol/L.
se 0,1 mol está em 1000 mL, 0,05 mol está em 500 mL
Da densidade, temos que uma massa chamada m1 está em 1 mL, então uma massa m2 (0,05 mol x MM HCl) está em V (volume que queremos), como segue:
m1 ----------------------------------- 1 mL
0,05 mol x MM HCl ------------ V
Esse cálculo organizado algebricamente fica
V = 0,05 MM HCl / d
Mas temos que fazer a correção desse V para um Título C%, que não é 100%, então fazemos mais uma regra de 3, para o caso de um reagente não puro:
V ----------- C%
y ----------- 100%
Daí conclui-se que y = V.100%/C%
E substituindo pelo V já encontrado anteriormente:
y = (0,05 MM HCl . 100%) / (d . C%)
O comentário do professor poderia ser em vídeo, devido a complexidade da questão
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo