Questões de Concurso
Para educação
Foram encontradas 99.776 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
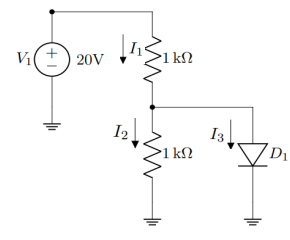
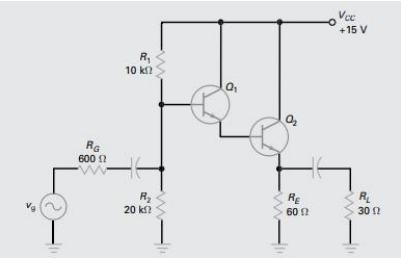

Considere o circuito a seguir com a tensão base emissor em 0,7 V para responder à questão.
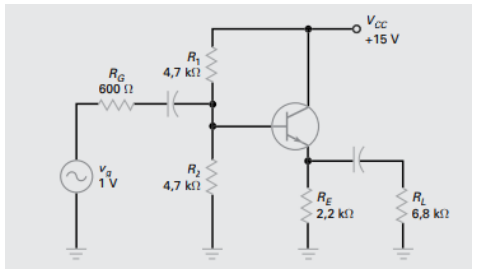
Considere o circuito a seguir com a tensão base emissor em 0,7 V para responder à questão.

Quanto a dispositivos semicondutores, é correto afirmar que
1) Quanto maior a distância de um elétron em relação ao núcleo, maior o estado de energia.
2) Os elétrons livres, em um material devido somente a causas externas, são chamados de portadores intrínsecos.
3) Em dispositivos condutores, a resistência diminui à medida que o calor aumenta.
Está(ão) correta(s)
A figura abaixo mostra uma representação simplificada do ciclo biogeoquímico do nitrogênio:
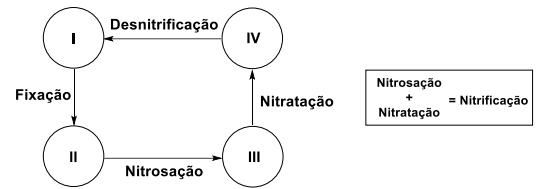
As espécies I, II, III e IV são, respectivamente:
Observe as estruturas dos ácidos abaixo:
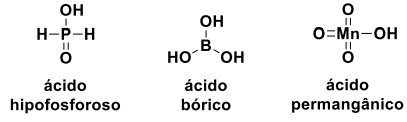
Sobre esses ácidos, analise as seguintes afirmações:
1. O ácido hipofosforoso possui três hidrogênios ionizáveis.
2. No ácido permangânico, o número de oxidação do Mn é +7.
3. O ácido bórico possui hibridação sp2 e geometria trigonal plana.
4. Devido à presença do metal, o ácido permangânico é o mais fraco.
Estão corretas, apenas:
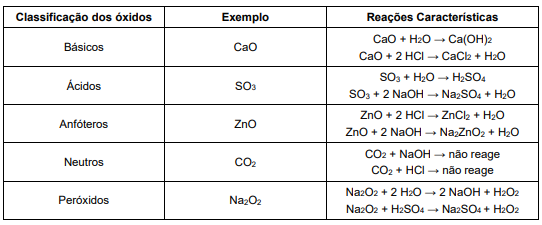
Ao observar a tabela, o professor precisou explicar ao estudante que um exemplo estava errado e não correspondia à classificação sugerida. A categoria cujo exemplo está incorreto é a dos óxidos:
Usado para a limpeza de peças e ferramentas, o ácido muriático é uma solução impura de ácido clorídrico e pode ser encontrado em lojas de materiais de construção. Com o objetivo de determinar a concentração de um lote desse produto em termos de porcentagem de HCl (m/V), um químico reagiu uma alíquota de 50mL do ácido muriático comercial com carbonato de cálcio em excesso, conforme a reação:
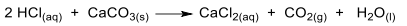
Nesse experimento, o volume coletado de CO2 foi 6,15L a 27oC e 1 atm. Qual é a porcentagem de HCl (m/V) na amostra de ácido muriático?
Massas molares (g/mol): H = 1; C = 12; O = 16; Cl = 35,5; Ca = 40
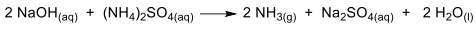
Considere que, em uma indústria química, são colocados em um reator 60kg de NaOH, 66kg de (NH4)2SO4 e água suficiente para solubilizar os reagentes. A reação ocorre até que um dos reagentes seja completamente consumido. Considerando as CNTP, o volume obtido de NH3(g) é:
Massas molares (g/mol): H = 1; O = 16; N = 14; Na = 23; S = 32