Questões de Concurso
Sobre química
Foram encontradas 13.691 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Internet: <qnesc.sbq.org.br> (com adaptações).
A partir do texto apresentado, julgue o item a seguir.
O etanol é classificado como uma molécula anfótera, já que se dissolve em meios polares e apolares.
Internet: <qnesc.sbq.org.br> (com adaptações).
A partir do texto apresentado, julgue o item a seguir.
As forças de atração tendem a ser mais fortes no estado sólido que no estado líquido, o que faz a velocidade molecular também ser maior nos sólidos que nos líquidos.
Internet: <qnesc.sbq.org.br> (com adaptações).
A partir do texto apresentado, julgue o item a seguir.
A ligação de hidrogênio é a interação intermolecular mais forte que há, por isso a água, mesmo sendo uma molécula de baixa massa molecular, possui elevada temperatura de ebulição.
Dados: massa molar do NaCl = 58,5g/mol
Dados: Massas atômicas (u), em valores aproximados: K = 39; C = 12; H = 1; O = 16; Cl = 35,5.
Dados: Massas atômicas (u), em valores aproximados: K = 39; C = 12; H = 1; O = 16.
O valor que mais se aproxima da massa (em gramas) desse produto comercial necessária para preparar 500,00 mL da solução é:
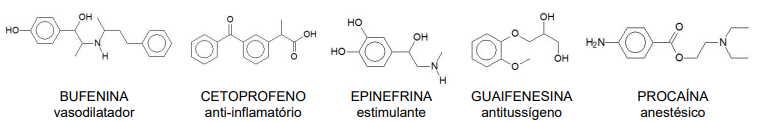
O composto que NÃO apresenta atividade óptica é:
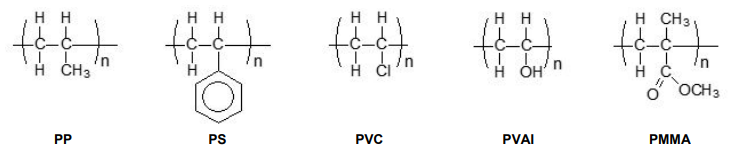
Assinale a alternativa que apresenta o polímero solúvel em água.
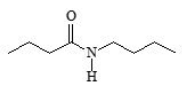
Assinale a alternativa que apresenta um metâmero do composto apresentado na figura.
O2 + 2 Pb → 2 PbO 2 PbO + 2 H2SO4 → 2 PbSO4 + 2 H2O 2 PbSO4 + 4 H+ + 4 e– → 2 Pb + 2 H2SO4 2 H+ + 2 e– → H2
Considerando o fenômeno exposto, assinale a alternativa que apresenta a ddp (ΔE0) gerada na recombinação do O2 com o H2.
Dados:

MS(s) → M+2 + S–2 H2S → H+ + HS– HS– → H+ + S–2
Assinale a alternativa que apresenta corretamente a expressão que relaciona a solubilidade (s) do composto MS com o pH da solução.
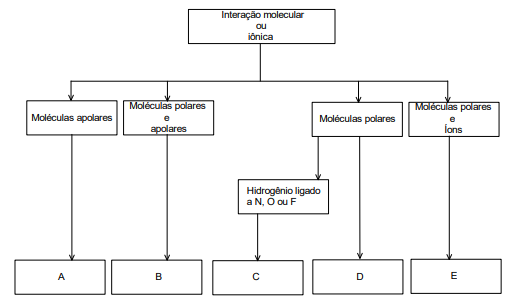
Considerando o fluxograma apresentado, assinale a alternativa que correlaciona corretamente o tipo de ligação intermolecular com as letras A, B, C, D e E, respectivamente.
Fe0 (s) → Fe+2 + 2 e– 2H2O + 2 e– → H2 + 2 OH– Fe+2 + 2 OH– → Fe(OH)2 4 Fe(OH)2 + 2 H2O + O2 → 4 Fe(OH)3 2 Fe(OH)3 → 2 Fe2O3.H2O + 2 H2O
Considerando as equações do processo de corrosão eletroquímica do ferro metálico, assinale a alternativa que apresenta corretamente a equação global balanceada do referido processo.
Método
1. Método argentimétrico de Fajans. 2. Gravimetria por precipitação. 3. Titulação por complexação. 4. Titulação com permanganato de potássio (Permanganometria).
Aplicação
( ) Determinação do índice de dureza em água potável.
( ) Determinação do teor de íons cloreto em água.
( ) Determinação de peróxido de hidrogênio em água oxigenada.
( ) Determinação de íons cálcio em água salina, precipitando-o como oxalato de cálcio e pesando-o na forma de óxido de cálcio.
A ordem é, respectivamente,