Questões de Concurso
Para if-sp
Foram encontradas 1.803 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
MnO4 - + H2C2O4 + H+ → Mn2+ + CO2 + H2O
Após o correto balanceamento da reação redox descrita, a soma dos coeficientes estequiométricos na equação será igual a
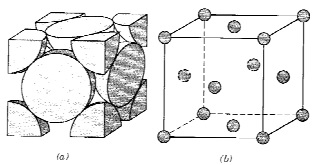 Fonte: CALLISTER, W.D. Ciência de Engenharia de Materiais: uma Introdução, 5ª edição, Rio de Janeiro: LTC,
Fonte: CALLISTER, W.D. Ciência de Engenharia de Materiais: uma Introdução, 5ª edição, Rio de Janeiro: LTC, O número de coordenação do níquel e o número de átomos de níquel por célula unitária são, respectivamente,
Dados: Densidade do etilenoglicol: 1,1 g cm-3 .
Densidade da água: 1,0 g cm-3
Kf = 1,9 K mol -1 Kg
H = 1 g mol -1 ; O = 16 g mol -1 ; C = 12 g mol -1
N2O5 (g) → 2 NO2(g) + 1/2 O2(g)
A constante de velocidade desta reação é igual a 1,38 x 10-5 s-1 a uma dada temperatura. Se a concentração inicial do N2O5 for 4,0 x 10-3 mol L-1,em quanto tempo aproximadamente a concentração cai até 1,0 x 10-3 mol L-1 ?
Dados: ln 2,5 = 0,916; ln 10-1 = -2,302
A entalpia de formação do CS 2(l) a partir de seus elementos formadores tem ΔH = _____________ sendo, portanto uma reação _______________. Assinale a alternativa que contém os complementos corretos para a frase acima, respectivamente.
Dados:
Capacidade calorífica da água: 1 cal.g-1 . o C-1 .
Capacidade calorífica da solução neutralizada:1 cal.g-1 . o C-1 .
Densidade da água e de todas as soluções envolvidas: 1g.mL-1 .
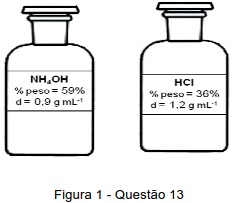
De acordo com as previsões do estudante, para produzir a quantidade de gás hidrogênio desejada ele deverá utilizar 500 mL de uma solução 6 mol L-1 preparada a partir de um dos reagentes acima. Indique a alternativa onde são apresentados, respectivamente, a identidade e o volume do reagente concentrado que o estudante deverá utilizar.
Dados: H = 1 g mol -1 ; N = 14 g mol -1 ; O = 16 g mol -1 ; Cl = 35,5 g mol -1 ; Zn = 65,4 g mol -1 .
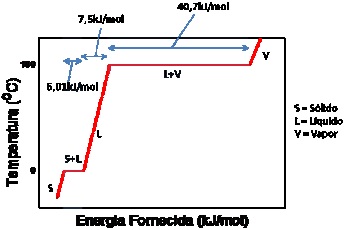
Figura 1 – Questão 12: Curva de aquecimento da água pura. (Adaptado). Fonte: Atkins, P. Jones, L. Chemistry, Molecules, Matter and Change. 4th ed. W. H. Freeman and Company. New York, 1999.
O mínimo de energia necessário para passar 1g de água do estado sólido para o estado vapor é: Dados: H= 1 g mol -1; O = 16 g mol -1
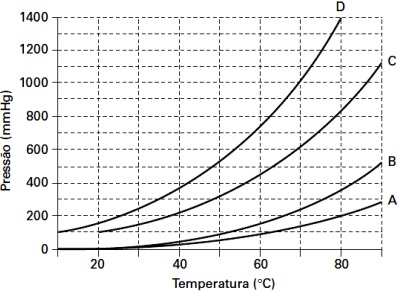
Figura 1 – Questão 11: Variação da pressão de vapor em função da temperatura para quatro diferentes substâncias puras.
Substância Massa Molar g mol-1 CHCl3 (Clorofórmio) 119,5
H2O (água) 18 CH3CH2OH (etanol) 46 CH2(OH)COOH (ácido glicólico) 76
As curvas apresentadas no gráfico foram obtidas em experimentos utilizando as substâncias listadas na Tabela 1. Identifique a alternativa que associa corretamente as curvas do gráfico às suas respectivas substâncias.
As curvas apresentadas no gráfico foram obtidas em experimentos utilizando as substâncias listadas na Tabela 1. Identifique a alternativa que associa corretamente as curvas do gráfico às suas respectivas substâncias.
I3- + 2e- ⇌ 3 I -
Considerando as informações fornecidas acima, qual a quantidade de matéria de I3 - consumida após a passagem de 0,193 A durante 500 s ?
Dado: Constante de Faraday = 96500 C mol -1
Dado: caminho óptico (b)= 1cm
Lei de Lambert-Beer A = ε b. c
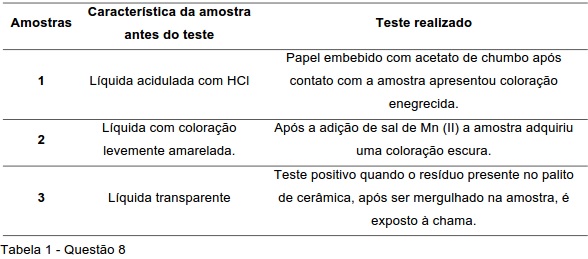
Com bases nos resultados dos testes, as amostras podem ser caracterizadas como:
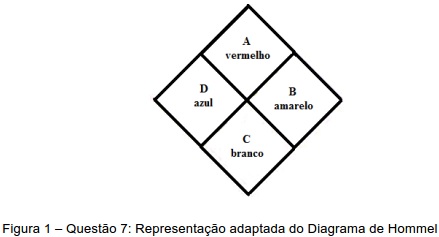
As letras A, B, C, e D presentes na representação do diagrama de Hommel (figura 1) estão associadas aos seguintes riscos, respectivamente:
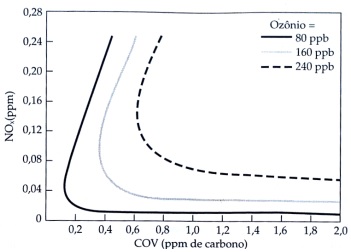
Figura 1 – Questão 5: Relação entre as concentrações de NOx e COV no ar e a concentração resultante de ozônio produzido por sua reação. (Adaptado). Fonte: BAIRD, C. Química Ambiental, 2ª ed. Porto Alegre: Bookman, 2002. p.116.
A partir do conhecimento envolvido no fenômeno do smog fotoquímico e de acordo com os dados apresentados na figura acima, pode-se afirmar que:
Dados: Mg = 24,3 g mol -1 ; H = 1,0 g mol -1 ;Cl = 35,5 g mol -1 ; log 2=0,30.
Ag | AgBr(s)| Br – (c=0,10) || Cl – (c=0,01) | AgCl(s)| Ag
Qual o potencial fornecido pela célula representada acima?
Dados:
AgBr(s) + 1e- → Ag(s)+ Br – E0 = +0,0713V
AgCl(s) + 1e- → Ag(s)+ Cl – E0 = +0,22V
a 25o C: 2,303 RT/F = 59mV